
水中溶氧量(DO)是衡量水體自凈能力的一個指標,通常用每升水中溶解氧分子的質量表示,單位mg/L,我國《地表水環境質量標準》規定,生活飲用水源的DO不能低于5mg/L。某化學小組同學設計了下列裝置(夾持裝置略),測定某河水的DO。
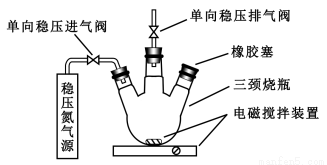
1、測定原理:
堿性條件下,O2將Mn2+氧化為MnO(OH)2:①2Mn2++O2+4OH?=2 MnO(OH)2↓
酸性條件下,MnO(OH)2將I?氧化為I2:②MnO(OH)2+I?+H+→Mn2++I2+H2O(未配平),用Na2S2O3標準溶液滴定生成的I2:③2S2O32?+I2=S4O62?+2I?
2、測定步驟
a.安裝裝置,檢驗氣密性,充N2排盡空氣后,停止充N2。
b.向燒瓶中加入200mL水樣。
c.向燒瓶中依次迅速加入1mLMnSO4無氧溶液(過量)、2mL堿性KI無氧溶液(過量),開啟攪拌器,至反應①完全。
d攪拌并向燒瓶中加入2mL硫酸無氧溶液至反應②完全,溶液為中性或弱酸性。
e.從燒瓶中取出40.00mL溶液,以淀粉作指示劑,用0.01000mol/L Na2S2O3溶液進行滴定,記錄數據。
f.……
g.處理數據(忽略氧氣從水樣中的逸出量和加入試劑后水樣體積的變化)。
回答下列問題:
(1)配置以上無氧溶液時,除去所用溶劑水中氧的簡單操作為__________。
(2)在橡膠塞處加入水樣及有關試劑應選擇的儀器為__________。
①滴定管②注射器③量筒
(3)攪拌的作用是__________。
(4)配平反應②的方程式,其化學計量數依次為__________。
(5)步驟f為__________。
(6)步驟e中達到滴定終點的標志為__________。若某次滴定消耗Na2S2O3溶液4.50mL,水樣的DO=__________mg/L(保留一位小數)。作為飲用水源,此次測得DO是否達標:__________(填“是”或“否”)
(7)步驟d中加入硫酸溶液反應后,若溶液pH過低,滴定時會產生明顯的誤差,寫出產生此誤差的原因(用離子方程式表示,至少寫出2個)__________。
 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案 名師點睛字詞句段篇系列答案
名師點睛字詞句段篇系列答案科目:高中化學 來源:2015-2016學年四川省成都市高二下4月月考化學試卷(解析版) 題型:選擇題
下列說法不正確的是( )
A.σ鍵比π鍵重疊程度大,形成的共價鍵強
B.兩個原子之間形成共價鍵時,最多有一個σ鍵
C.氣體單質中,一定有σ鍵,可能有π鍵
D.N2分子中有一個σ鍵,2個π鍵
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西重點中學協作體高二下學期期末化學試卷(解析版) 題型:填空題
I、離子液體是一種室溫熔融鹽,為非水體系,由有機陽離子、Al2Cl7-和AlCl4-組成的離子液體作電解液時,可在鋼制品上電鍍鋁。(9分)
(1)為測定鍍層厚度,用NaOH溶液溶解鋼制品表面的鋁鍍層,當反應轉移6 mol電子時,所得還原產物的物質的量為________mol。(2分)
(2)用鋁粉和Fe2O3做鋁熱反應實驗,需要的試劑還有________。(2分)
a.KCl b.KClO3 c.MnO2 d.Mg
取少量鋁熱反應所得的固體混合物,將其溶于足量稀H2SO4,滴加KSCN溶液無明顯現象,________(填“能”或“不能”)說明固體混合物中無Fe2O3,理由是_____________________________________(用離子方程式說明)。(5分)
II、焊接鋼鐵時常用的焊藥為氯化銨,其作用是消除焊接處的鐵銹。發生的反應體系中共有六種物質:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。(6分)
(1)根據題意,可判斷出X是________(1分)(寫化學式)。
(2)寫出并配平該反應的化學方程式:_________________________;
(3)發生還原反應的物質是________,反應中2mol的氧化劑能_______(1分)(填“失去”或“得到”)_____mol電子。
(4)反應中被氧化產生了5.6L(標準狀況)的氣體時,被還原的物質的質量為____________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川省資陽市高二下學期期末化學試卷(解析版) 題型:計算題
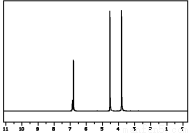
取1.38 g由C、H、O三種元素組成的有機物A,在足量氧氣中完全燃燒,若將燃燒產物通過堿石灰,堿石灰質量增加4.42 g;若將燃燒產物通過濃硫酸,濃硫酸質量增加0.9 g;已知:A的蒸氣對氫氣的相對密度為69。
(1)通過計算確定A的分子式;
(2)A分子的核磁共振氫譜如圖,紅外光譜顯示分子中氧原子只以羥基形式存在,試寫出其結構簡式。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川省資陽市高二下學期期末化學試卷(解析版) 題型:填空題
根據所學知識回答下列問題:
(1)用離子方程式表示鹽堿地(含較多Na2CO3)呈堿性的原因:____________;相同濃度的Na2CO3溶液與NaHCO3溶液等體積混合后,溶液中c(HCO3-) ____c(CO32-)(用“>、<、=”表示)。
(2)常溫時,AlCl3溶液呈____性(填“酸”、“堿”或“中”),將AlCl3溶液蒸干,灼燒,得到的固體產物是________。AlCl3溶液和NaHCO3溶液混合時發生反應的離子方程式為____________________。
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(天津卷精編版) 題型:選擇題
下列實驗的反應原理用離子方程式表示正確的是( )
A.室溫下,測得氯化銨溶液pH<7,證明一水合氨的是弱堿:NH4++2H2O=NH3·H2O+H3O+
B.用氫氧化鈉溶液除去鎂粉中的雜質鋁:2Al+2OH-+2H2O=2AlO2-+3H2↑
C.用碳酸氫鈉溶液檢驗水楊酸中的羧基:
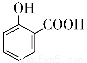 +2HCO3-→
+2HCO3-→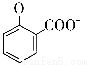 +2H2O+2CO2↑
+2H2O+2CO2↑
D.用高錳酸鉀標準溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(北京卷精編版) 題型:推斷題
功能高分子P的合成路線如下:
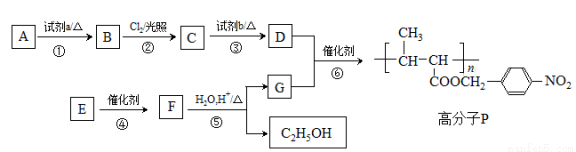
(1)A的分子式是C7H8,其結構簡式是___________________。
(2)試劑a是_______________。① ③ ② ④ ⑤ ⑥ n
(3)反應③的化學方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能團:_______________。
(5)反應④的反應類型是_______________。
(6)反應⑤的化學方程式:_______________。
(5)已知: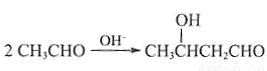 。
。
以乙烯為起始原料,選用必要的無機試劑合成E,寫出合成路線(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(新課標3卷精編版) 題型:選擇題
已知異丙苯的結構簡式如下,下列說法錯誤的是( )
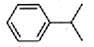
A. 異丙苯的分子式為C9H12
B. 異丙苯的沸點比苯高
C. 異丙苯中碳原子可能都處于同一平面
D. 異丙苯和苯為同系物
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(海南卷精編版) 題型:選擇題
由反應物X轉化為Y和Z的能量變化如圖所示。下列說法正確的是
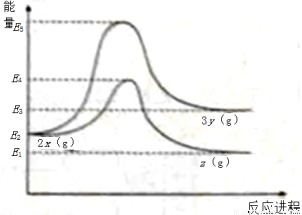
A.由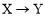 反應的ΔH=E5?E2
反應的ΔH=E5?E2
B.由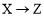 反應的ΔH<0
反應的ΔH<0
C.降低壓強有利于提高Y的產率
D.升高溫度有利于提高Z的產率
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com