
①給燒瓶加熱必須使用石棉網
②制取蒸餾水的裝置溫度計要插入加熱的水中
③分液時要將分液漏斗上口玻璃塞打開,或使塞上凹槽對準漏斗上的小孔
④振蕩分液漏斗中的溶液時,要一只手按住口部,另一只手握住活塞部分顛倒振蕩
⑤容量瓶的刻度線上方有水珠未干燥就開始配制溶液
⑥實驗室制取氯氣時,為了防止環境污染,多余的氯氣可以用氫氧化鈣溶液吸收
A. ①②③ B. ③④⑤ C. ②⑤⑥ D. ③⑤⑥
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2016-2017學年陜西省高一上期中化學卷(解析版) 題型:選擇題
宋代著名法醫學家宋慈的《洗冤集錄》中有“銀針驗毒”的記載,“銀針驗毒”的原理是4Ag+2H2S+O2=2X+2H2O,其中H2S是
A.既不是氧化劑又不是還原劑 B.還原劑
C.既是氧化劑又是還原劑 D.氧化劑
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省南昌市等五校高二上聯考二化學試卷(解析版) 題型:填空題
運用化學反應原理研究物質的性質具有重要意義。請回答下列問題:
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
則CO(g)+2H2(g) CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
(2)一定壓強下,在容積為2 L的密閉容器中充入1mol CO與2 mol H2,在催化劑作用下發生反應:CO(g)+2H2(g)  CH3OH(g) ΔH ,平衡轉化率與溫度、壓強的關系如圖所示。
CH3OH(g) ΔH ,平衡轉化率與溫度、壓強的關系如圖所示。
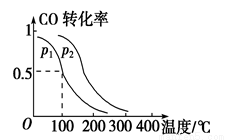
p2 p1 (填“大于”、“小于”或“等于”);
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的離子方程式_______________。
(4)25℃,兩種酸的電離平衡常數如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的電離平衡常數表達式K=_________。
②0.10 mol·L-1 Na2SO3溶液中離子濃度由大到小的順序為_________。
③H2SO3溶液和NaHCO3溶液混合,主要反應的離子方程式為_________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省南昌市等五校高二上聯考二化學試卷(解析版) 題型:選擇題
現有常溫下的四種溶液(如下表),下列有關敘述正確的是( )
① | ② | ③ | ④ | |
氨水 | 氫氧化鈉 | 醋酸 | 鹽酸 | |
pH | 11 | 11 | 3 | 3 |
A.分別加水稀釋10倍,四種溶液的pH為:①>②>④>③
B.溫度上升10℃,四種溶液的pH不變
C.③④中分別加入適量的氯化銨晶體后,③的pH減小,④的pH不變
D.將①④兩種溶液等體積混合,所得溶液中c (C1-) >c NH4+)>c (H+)>c (OH- )
查看答案和解析>>
科目:高中化學 來源:2016-2017學年福建省四地六校高一上學期12月月考化學試卷(解析版) 題型:填空題
(1)配平:
Cu + HNO3(稀) == Cu(NO3)2 + NO↑ + H2O
(2)在以上反應中,還原劑是 ,被還原的元素是 ,還原產物是 。
(3)若生成2mol的N O氣體,總共轉移的電子數是 mol。
O氣體,總共轉移的電子數是 mol。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年福建省四地六校高一上學期12月月考化學試卷(解析版) 題型:選擇題
阿伏加德羅常數為NA,下列敘述中正確的是( )
A.18gD2O含有的電子數為10NA
B.同溫、同壓下, 相同體積的氟氣和氬氣所含的原子數相等
相同體積的氟氣和氬氣所含的原子數相等
C.標準狀況下,11.2L四氯化碳所含分子數約為0.5NA個
D.室溫下,46gN2O4和NO2的混合氣體中含有的原子數約為3NA
查看答案和解析>>
科目:高中化學 來源:2016-2017學年福建省四地六校高一上學期12月月考化學試卷(解析版) 題型:選擇題
同溫、同壓下,等體積的O2和O3兩種氣體,下列有關說法錯誤的是( )
A.所含分子數目相同 B.所含氧原子物質的量之比為2∶3
C.質量之比為2∶3 D.密度之比為3∶2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年福建省四地六校高二上學期12月月考化學試卷(解析版) 題型:選擇題
已建立化學平衡的某可逆反應,當改變條件使化學平衡向正反應方向移動時,下列有關敘述正確是( )
①生成物的質量分數一定增加
②生成物的產量一定增大
③反應物的轉化率一定增大
④反應物的濃度一定降低
⑤正反應速率一定大于逆反應速率
⑥平衡常數一定增大
A.①② B.③⑤ C.②⑤ D.④⑥
查看答案和解析>>
科目:高中化學 來源:2017屆浙江省高三上統考四化學試卷(解析版) 題型:填空題
【加試題】(10分)碳、硫和氮元素及其化合物的處理是資源利用和環境保護的重要研究課題。
(1)CO可轉化成二甲醚,原理為:2CO(g) + 4H2(g) CH3OCH3(g) + H2O(g),已知一定條件下,該反應中CO的平衡轉化率隨溫度、投料比[n(H2)/n(CO)]的變化曲線如圖1
CH3OCH3(g) + H2O(g),已知一定條件下,該反應中CO的平衡轉化率隨溫度、投料比[n(H2)/n(CO)]的變化曲線如圖1
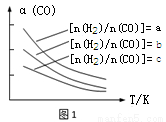
若溫度升高,則反應的平衡常數K將 (填“增大”、“減小”或“不變”)。
(2)SO2的水溶液呈酸性,某溫度下,0.02 mol•L﹣1亞硫酸水溶液的pH等于2,若忽略亞硫酸的二級電離和H2O的電離,則該溫度下亞硫酸的一級電離常數Ka1= 。
(3)已知: 反應1:2SO2(g) + O2(g) ? 2SO3(g) △H1;
反應1:2SO2(g) + O2(g) ? 2SO3(g) △H1;
反應2:2NO(g) + O2(g) ? 2NO2(g) △H2;
反應3:SO2(g) + NO2(g) ? SO3(g) + NO(g) △H3;
若△ H1<△H2<0,則反應3屬于 (填“放熱”或“吸熱”)反應。
H1<△H2<0,則反應3屬于 (填“放熱”或“吸熱”)反應。
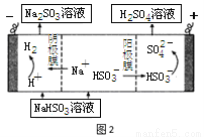
(4)若用少量NaOH溶液吸收SO2氣體,對產物NaHSO3進一步電解可制得硫酸,電解原理示意圖如圖2。電解時陽極的電極反應式為 。
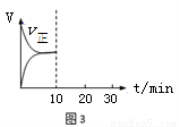
(5)在恒溫密閉容器中通入SO2和NO2各1mol發生反應3:SO2(g) + NO2(g)? SO3(g) + NO(g),當反應達到平衡后,維持溫度和容積不變,10min時再通入各1mol的SO2和NO2的混合氣體,20min時再次平衡。兩次平衡時NO2的轉化率α1 α2(填“>”、“<”、“=”);請在圖3畫出正反應速率v正在10至30min間隨時間變化的曲線圖。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com