
【題目】(Ⅰ)工業上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)已知在某溫度和壓強下:
①2CO(g)+O2(g)=2CO2(g) △H= -566.0 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H= - 483.6 kJ·mol-1
③2CH3 OH(g)+3O2(g)=2CO2(g)+4H2 O(g) △H= -1275.6 kJ·mol-1
則在相同的溫度和壓強下,CO(g)與H2(g)合成CH3OH(g)的熱化學方程式是_________________________________________________________。
(2)某化學研究性學習小組模擬工業合成甲醇的反應,在容積固定為2L的密閉容器內充入1 molCO和 2 molH2,加入合適催化劑(體積可以忽略不計)后在250°C開始反應,甲醇的物質的量的變化如下:
反應時間/min | 0 | 5 | 10 | 15 | 20 | 25 |
甲醇/mol | 0 | 0.22 | 0.36 | 0.45 | 0.5 | 0.5 |
則從反應開始到20min時,以CO表示的平均反應速率=_________________,該溫度下平衡
常數K=________________,若升高溫度則K值__________(填“增大”、“減小”或“不變”);
(3)下列描述中能說明上述反應已達平衡的是________________;
A.2 v (H2)正= v (CH3OH)逆 B.容器內氣體的平均摩爾質量保持不變
C.容器中氣體的壓強保持不變 D.單位時間內生成 n molCO 的同時生成 2n molH2
(Ⅱ)回答下列問題:
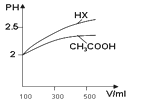
(1)體積均為100mL pH=2的CH3COOH與一元酸HX,加水稀釋過程中pH與溶液體積的關系如圖所示,則Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
(2)25℃時,CH3COOH與CH3COONa的混合溶液,若測得pH=6,則溶液中C(CH3COO)- c(Na+)=________mol·L-1(填精確值)。
【答案】 CO(g)+2H2(g) ![]() CH3OH(g) △H= -128.8 KJ/mol 0.0125mol/(L·min) 4 (mol/L)-2 減小 B C > 9.9×10-7
CH3OH(g) △H= -128.8 KJ/mol 0.0125mol/(L·min) 4 (mol/L)-2 減小 B C > 9.9×10-7
【解析】試題分析:(Ⅰ)(1)根據蓋斯定律書寫CO(g)與H2(g)合成CH3OH(g)的熱化學方程式;(2)根據![]() 計算反應速率;利用“三段式”計算平衡常數;正反應放熱,升高溫度平衡逆向移動;(3)根據化學平衡特征分析;(Ⅱ)(1)酸性越弱稀釋相同倍數PH變化越小;(2)根據電荷守恒計算;
計算反應速率;利用“三段式”計算平衡常數;正反應放熱,升高溫度平衡逆向移動;(3)根據化學平衡特征分析;(Ⅱ)(1)酸性越弱稀釋相同倍數PH變化越小;(2)根據電荷守恒計算;
解析:(Ⅰ)(1)①2CO(g)+O2(g)=2CO2(g) △H= -566.0 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H= - 483.6 kJ·mol-1
③2CH3 OH(g)+3O2(g)=2CO2(g)+4H2 O(g) △H= -1275.6 kJ·mol-1
根據蓋斯定律①![]() +②-③
+②-③![]() 得 CO(g)+2H2(g)
得 CO(g)+2H2(g) ![]() CH3OH(g) △H= -128.8 KJ/mol;
CH3OH(g) △H= -128.8 KJ/mol;
(2)
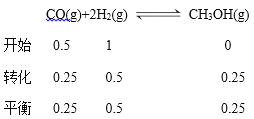
根據圖表數據,20min時甲醇的濃度為0.25mol/L,則消耗CO的濃度是0.25mol/L,v(CO)= ![]() 0.0125mol/(L·min);平衡常數K=
0.0125mol/(L·min);平衡常數K=  ;正反應放熱,升高溫度平衡逆向移動,平衡常數減小;
;正反應放熱,升高溫度平衡逆向移動,平衡常數減小;
(3)A.平衡狀態時,正逆反應速率比等于系數比,2 v (H2)正= v (CH3OH)逆時正逆反應速率比不等于系數比,所以不是平衡狀態; B.根據質量守恒定律氣體質量不變,氣體物質的量是變量,根據 ,平均摩爾質量是變量,容器內氣體的平均摩爾質量保持不變一定平衡;C.容器體積不變、容器內氣體的物質的量是變量,所以壓強是變量,容器中氣體的壓強保持不變一定平衡; D.單位時間內生成 n molCO 的同時生成 2n molH2,都是表示逆反應速率,反應不一定平衡。故選BC;
,平均摩爾質量是變量,容器內氣體的平均摩爾質量保持不變一定平衡;C.容器體積不變、容器內氣體的物質的量是變量,所以壓強是變量,容器中氣體的壓強保持不變一定平衡; D.單位時間內生成 n molCO 的同時生成 2n molH2,都是表示逆反應速率,反應不一定平衡。故選BC;
(Ⅱ)回答下列問題:(1)酸性越弱稀釋相同倍數pH變化越小,根據提示,稀釋相同倍數HX的PH變化大于CH3COOH,所以Ka(HX)> Ka(CH3COOH);
(2)25℃時,pH=6的溶液中![]() 、
、![]() ,根據電荷守恒CH3COOH與CH3COONa的混合溶液, C(CH3COO) + C(OH)= c(Na+)+ c(H+),C(CH3COO) - c(Na+)= c(H+)-C(OH)=
,根據電荷守恒CH3COOH與CH3COONa的混合溶液, C(CH3COO) + C(OH)= c(Na+)+ c(H+),C(CH3COO) - c(Na+)= c(H+)-C(OH)= ![]() =9.9×10-7。
=9.9×10-7。


科目:高中化學 來源: 題型:
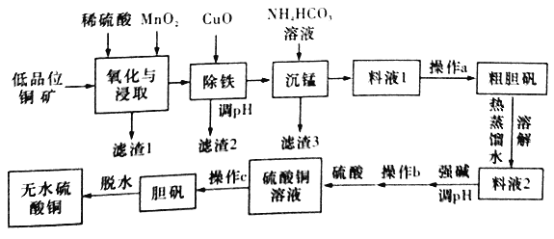
【題目】無水硫酸銅是一種重要的化學試劑,工業上用低品位鋼礦(合CuS、Cu2S、CuO,以及FeO、Fe2O3、SiO2等雜質)制備無水硫酸銅的流程如下圖所示:
(NH4)2SO4、CuSO4的溶解度(g)部分數據如下表所示:
溫度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
S(CuSO4)/g | 17 | 20.7 | 24.4 | 28.5 | 33.6 | 40 | 77 |
S[(NH4)SO4]/g | 73 | 75.4 | 78.1 | 81.0 | 84.5 | 87.8 | 102 |
(1)氧化與浸取過程中發生的反應之一為Cu2S被MnO2氧化時有一種非全屬單質生成,則該反應的離子方程式為____________,濾渣1的主要成分是__________(填化學式),除鐵時加入CuO能得到濾渣2的原理是__________________。
(2)除鐵后,為了判斷濾液中是否有Fe3+殘留,請設計實驗方案:__________。
(3)沉錳時還有一種酸性氣體生成,則沉錳時發生反應的離子方程式為___________。(已知pH=8.8時,Mn2+開始沉淀)。
(4)為了從料液1中盡可能多地析出粗膽礬,操作a的內容是__________(填名稱)。
(5)工業上利用上述原理制備膽礬。已知:298K時,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=8.0×10-38。離子濃度小于1×10-5mol/L時表明該離子已完全沉淀。常溫下,若某溶液中c(Cu2+)=2.2 mol/L,c(Fe3+)=O.001mol/L,加入氧化銅除鐵時,調節溶液pH范圍為________(lg5=0.7)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用硫酸渣(主要含Fe2O3、FeO,雜質為Al2O3和SiO2等)生產鐵基顏料鐵黃(FeOOH)的制備流程如下:

(1)“酸溶”時,Fe2O3與硫酸反應的化學方程式為____。
(2)濾渣I的主要成分是FeS2、S和______(填化學式);Fe3+被FeS2還原的離子方程式為______。
(3)“氧化”中,生成FeOOH的離子方程式為_______________。
(4)濾液II中溶質是Al2(SO4)3和______(填化學式):“洗滌”時,檢驗鐵黃表而已洗滌干凈的操作是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在標準狀況下,13g某氣體所含的分子數與14gCO 所含的分子數相等。此氣體在標準狀況下的密度為( )
A. 1.25g·L-1 B. 2.32 g·L-1 C. 1.65 g·L-1 D. 1.16 g·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列敘述中正確的是
A. 標準狀況下,22.4 L 14CO2與44 g 14CO2含分子數均為NA
B. 1 mol CH3COOH與足量CH3CH2OH在濃硫酸存在下共熱生成NA個乙酸乙酯分子
C. 常溫下,pH=13的NaOH溶液中含OH-離子數為0.1 NA
D. 濃度為2 mol/L的FeCl3溶液500 mL水解后生成Fe(OH)3膠體粒子數目小于NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
①標準狀況下,0.2 mol任何物質的體積均為4.48 L
②若1 mol氣體的體積為22.4 L,則它一定處于標準狀況下
③標準狀況下,1 LCO和1 L H2O的物質的量相同
④標準狀況下,1 g H2和14 g N2的體積相同
⑤28 g CO的體積為22.4 L
⑥兩種物質的物質的量相同,則它們在標準狀況下的體積也相同
⑦在同溫同體積時,氣體物質的物質的量越大,則壓強越大
⑧同溫同壓下,氣體的密度與氣體的相對分子質量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ④⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣在工業上有著重要的用途,某興趣小組在實驗室中模擬工業上用氯氣制備無水氯化鋁(無水AlCl3(183℃升華)遇潮濕空氣即產生大量白霧).可用下列裝置制備.
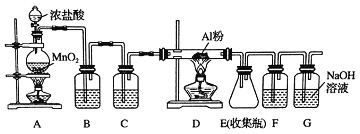
(1)裝置B中盛放_____溶液,其作用是_____.F中的是_____溶液,其作用是_____.用一件儀器裝填適當試劑后也可起到F和G的作用,所裝填的試劑為_____.
(2)裝置A實驗開始時,先檢查裝置氣密性,接下來的操作依次是_____(填序號).
A.往燒瓶中加入MnO2粉末 B.加熱 C.往燒瓶中加入濃鹽酸
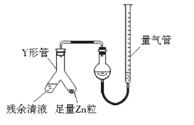
(3)制備反應會因鹽酸濃度下降而停止.為測定反應殘余液中鹽酸的濃度,探究小組同學提出很多實驗方案,其中方案之一為讓殘留的液體與足量Zn反應,測量生成的H2體積.裝置如右圖所示(夾持器具已略去).
①使Y形管中的殘余清液與鋅粒反應的正確操作是將_____轉移到_____中.
②反應完畢,每間隔1分鐘讀取氣體體積、氣體體積逐漸減小,直至不變.氣體體積逐次減小的原因是_____(排除儀器和實驗操作的影響因素)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com