
【題目】I.用活性炭還原處理氮氧化物,有關反應為C(s)+2NO(g)![]() N2(g)+CO2(g)。在2L恒容密閉容器中加入足量C與NO發生反應,所得數據如表,回答下列問題。
N2(g)+CO2(g)。在2L恒容密閉容器中加入足量C與NO發生反應,所得數據如表,回答下列問題。
實驗編號 | 溫度/℃ | 起始時NO的物質的量/mol | 平衡時N2的物質的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
(1)寫出上述反應的平衡常數表達式______。
(2)①結合表中數據,判斷該反應的ΔH____0(填“>”或“<”),理由是_____
②判斷該反應達到平衡的依據是_____。
A.容器內氣體密度恒定 B.容器內各氣體濃度恒定
C.容器內壓強恒定 D.2v正(NO)=v逆(N2)
II.結合下表回答下列問題(均為常溫下的數據):
酸 | 電離常數(Ka) |
CH3COOH | 1.8×10-5 |
HClO | 3×10-8 |
H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 |
| <>H2S | K1=1.3×10-7 K2=7.1×10-15 |
請回答下列問題:
(1)同濃度的CH3COO-、![]() 、
、![]() 、
、![]() 、ClO-、S2-中結合H+的能力最弱的是____。
、ClO-、S2-中結合H+的能力最弱的是____。
(2)常溫下0.1mol·L-1的CH3COOH溶液在加水稀釋過程中,下列表達式的數據一定變小的是___(填字母)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)/c(OH-) D.c(OH-)
(3)0.1mol·L-1的H2C2O4溶液與0.1mol·L-1的KOH的溶液等體積混合后所得溶液呈酸性,該溶液中各離子濃度由大到小的順序為_____。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物質的量濃度的大小關系是CH3COOK___NaClO,兩溶液中:c(Na+)-c(ClO-)___c(K+)-c(CH3COO-)(填“>”“<”或“=”)。
(5)向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此時溶液pH=____。
【答案】![]() > 計算700℃和800℃的平衡常數K1<K2,所以ΔH>0 AB
> 計算700℃和800℃的平衡常數K1<K2,所以ΔH>0 AB ![]() AC c(K+)>c(
AC c(K+)>c(![]() )>c(H+)>c(C2O42-)>c(OH-) > = 5
)>c(H+)>c(C2O42-)>c(OH-) > = 5
【解析】
I.(1)由方程式可知,該反應的化學平衡常數K為![]() ;
;
(2)①建立三段式計算700℃和800℃的平衡常數,比較平衡常數的大小,判斷平衡移動方向;
②化學平衡的標志是正逆反應速率相同,各組分濃度保持不變;
II.(1) 電離平衡常數越大,酸性越強,酸越強其對應酸根離子結合氫離子能力越弱;
(2)醋酸為弱酸,稀釋過程中醋酸的電離程度增大,溶液中氫離子、醋酸根離子的物質的量增大,醋酸的物質的量減小,由于溶液體積變化程度更大,則溶液中氫離子、醋酸根離子、醋酸的濃度減小;由于水的離子積不變,則溶液中氫氧根離子濃度增大;
(3)0.1mol·L-1的H2C2O4溶液與0.1mol·L-1的KOH的溶液等體積混合,反應生成KHC2O4,KHC2O4溶液呈酸性,說明溶液中HC2O4-電離大于水解;
(4)根據電離平衡常數可知:酸性CH3COOH>HClO,則NaClO的水解程度大于CH3COOK;
(5)依據醋酸的電離平衡常數和題給數據計算可得。
I.(1)由方程式可知,該反應的化學平衡常數K為![]() ;
;
(2)①由題意建立700℃時平衡三段式如下:
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起(mol/L) 0.2 0 0
變(mol/L) 0.09 0.045 0.045
平(mol/L) 0.11 0.045 0.045
化學平衡常數K1=![]() =
=![]() ≈0.17
≈0.17
由題意建立800℃時平衡三段式如下:
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起(mol/L) 0.12 0 0
變(mol/L) 0.08 0.04 0.04
平(mol/L) 0.04 0.04 0.04
化學平衡常數K2=![]() =
=![]() =1
=1
由計算結果可知,700℃時平衡常數K1小于800℃的平衡常數K2,說明升高溫度,平衡向正反應方向移動,則該反應為吸熱反應,ΔH>0,故答案為:ΔH>0;計算700℃和800℃的平衡常數K1<K2,所以ΔH>0;
②A、C為固體,該反應是一個氣體質量增大的反應,恒容密閉容器中混合氣體的密度保持不變,說明氣體的質量不變,能說明反應達平衡狀態;
B、容器內各氣體濃度恒定,說明正逆反應速率相等,能說明反應達平衡狀態;
C、該反應是一個氣體體積不變的反應,容器內壓強始終保持不變,不能說明反應達平衡狀態;
D、2υ正(NO)=υ逆(N2),NO、N2表示的正、逆反應速率之比不等于計量數之比,說明反應沒有達到平衡狀態;
故答案為:AB;
II.(1)根據表中數據可知,酸的電離出平衡常數大小為:H2C2O4> HC2O4—>CH3COOH>H2CO3> H2S > HClO >HCO3->HS—,電離平衡常數越大,酸性越強,所以酸性由強到弱的順序為:H2C2O4> HC2O4—>CH3COOH>H2CO3> H2S > HClO >HCO3->HS—,酸越強其對應酸根離子結合氫離子能力越弱,則結合H+的能力最弱的是HC2O4—,故答案為:HC2O4—;
(2)A、醋酸為弱酸,稀釋過程中醋酸的電離程度增大,溶液中H+離子物質的量增大, c(H+)減小,故符合題意;
B、醋酸的電離常數Ka=![]() ,則
,則![]() =
=![]() ,醋酸稀釋過程中,溫度不變電離常數不變,醋酸根濃度減小,
,醋酸稀釋過程中,溫度不變電離常數不變,醋酸根濃度減小,![]() 增大,則
增大,則![]() 增大,故不符合題意;
增大,故不符合題意;
C、水的離子積常數Kw=c(H+)c(OH-),醋酸稀釋過程中,溫度不變水的離子積常數不變,c(H+)減小,c(OH-)增大,則![]() 減小,故符合題意;
減小,故符合題意;
D、水的離子積常數Kw=c(H+)c(OH-),醋酸稀釋過程中,溫度不變水的離子積常數不變,c(H+)減小,c(OH-)增大,故不符合題意;
故答案為:AC;
(3)0.1mol·L-1的H2C2O4溶液與0.1mol·L-1的KOH的溶液等體積混合,反應生成KHC2O4,KHC2O4溶液呈酸性,說明溶液中HC2O4-電離大于水解,則c(H+)>c(OH-),溶液中各離子濃度由大到小的順序為c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故答案為:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(4)根據電離平衡常數可知:酸性CH3COOH>HClO,則NaClO的水解程度大于CH3COOK,所以pH相同時CH3COOK的濃度大于NaClO;由于兩溶液的pH相同,則兩溶液中氫離子、氫氧根離子的濃度相同,根據電荷守恒可得:c(Na+)-c(ClO-)= c(K+)-c(CH3COO-),故答案為:>;=;
(5)醋酸的電離平衡常數Ka=![]() = 1.8×10-5,溶液中c(CH3COOH):c(CH3COO-)=5:9,則c(H+)=1.8×10-5×
= 1.8×10-5,溶液中c(CH3COOH):c(CH3COO-)=5:9,則c(H+)=1.8×10-5×![]() =1.8×10-5×
=1.8×10-5×![]() = 1×10-5mol/L,則該溶液的pH=5,故答案為:5。
= 1×10-5mol/L,則該溶液的pH=5,故答案為:5。


科目:高中化學 來源: 題型:
【題目】有機物中碳原子和氫原子個數比為3∶4,不能與溴水反應卻能使酸性KMnO4溶液褪色。在鐵存在時與溴反應,能生成兩種一溴代物。該有機物可能是()
A. CH![]() C-CH3B.
C-CH3B. ![]() C. CH2=CHCH3D.
C. CH2=CHCH3D. 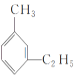
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于實驗室中四個裝置的說明符合實驗要求的是
A.若需制備較多量的乙炔可用此裝置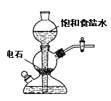
B.可用此裝置來制備硝基苯,但產物中可能會混有酸
C.可用此裝置來分離含碘的四氯化碳液體,最終在錐型瓶中可獲得碘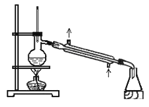
D.可用此裝置來制備乙酸乙酯并在燒瓶中獲得產物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法和解釋錯誤的是
A. 冰融化時,需破壞晶體中的全部氫鍵,所以冰融化時密度變大
B. 鹵化物![]() 從F到I,由于分子量增大,分子間范德華力增大,熔沸點也逐漸升高
從F到I,由于分子量增大,分子間范德華力增大,熔沸點也逐漸升高
C. 由于石墨晶體中層間距較遠,電子不易實現遷移,所以石墨的導電性只能沿石墨平面的方向
D. 金屬中的“電子氣”在電場中可以定向移動,所以金屬具有良好的導電性。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z是四種常見的短周期元素,其原子半徑隨原子序數變化如圖所示。已知 W 的一種核素的質量數為 18,中子數為 10;X 和 Ne 的核外電子數相差 1; 在Z所在的周期中,Z 元素的原子得電子能力最強;四種元素的最外層電子數之和為18。 請回答下列問題:
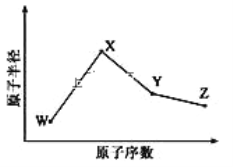
(1)X 元素位于元素周期表中位置為_____________。
(2)X 的單質和 Y 的單質相比,熔點較高的是____________(寫化學式) 。 Z 所在族的簡單氫化物中,沸點最高的是________(寫化學式),原因為_________________________。
(3)W、X、Z 三種元素形成的化合物中化學鍵類型為________;X2W2的電子式為___________________。
(4)Y 與 Z 形 成的化合物在常溫下是一種液態,它和足量水反應,生成一種弱酸和一種強酸,該反應的化學方程式為__________________________。
(5)Z 的氧化物很多,其中一種黃綠色氣體 M,其氧含量為 47.41%,可用于水處理, M 在液態和濃縮氣態時具有爆炸性 。 M 的化學式為_____________。 M 可與 NaOH 溶液反應生成兩種穩定的鹽,它們的物質的量之比為 1︰5,該反應的化學方程式為___________________。
(6)在 25°C、101kPa 下,已知 Y 的簡單氣態氫化物在氧氣中完全燃燒后恢復至原狀態, 平均每轉移 1mol 電子放熱 190kJ, 該反應的熱化學方程式為__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸鈉的溶液,恰好使鋇離子完全沉淀;另取一份加入含b mol硝酸銀的溶液,恰好使氯離子完全沉淀。則該混合溶液中鉀離子的濃度為( )。
A.0.1(b-2a) mol·L-1B.10(2a-b) mol·L-1
C.10(b-a) mol·L-1D.10(b-2a) mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液只含有下列離子:NH4+、Na+、Fe2+、NO3-、I、 SO32-、AlO2-中的四種(忽略水的電離),且各離子的物質的量濃度相等,現進行如下實驗:
①取少量該溶液加NaOH溶液共熱,產生刺激性氣味的氣體,未觀察到其它明顯現象;
②取少量該溶液加足量的硝酸,可觀察到紅棕色氣體,未觀察到沉淀生成。
根據上述實驗,下列說法正確的是()
A.根據實驗①只能確定原溶液中一定有![]() ,沒有Fe2+
,沒有Fe2+
B.取實驗②后的溶液滴加淀粉溶液變藍色
C.原溶液中可能含有NH4+、Na+、SO32-、I四種離子
D.取少量原溶液加酸性高錳酸鉀溶液,可能有兩種離子被氧化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分。表中所列的字母分別代表某一種化學元素。

下列說法正確的是( )
A. 沸點A2D<A2X
B. CA3分子是非極性分子
C. C形成的單質中σ鍵與π鍵個數之比為1∶2
D. B、C、D形成的氣態氫化物互為等電子體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25℃、101kPa的條件下,斷裂1molH—H鍵吸收436kJ能量,斷裂1molCl—Cl鍵吸收243kJ能量,形成1molH—Cl鍵放出431kJ能量。該條件下H2+Cl2![]() 2HCl反應中的能量變化可用如圖表示:
2HCl反應中的能量變化可用如圖表示:

現有1molH2和1molCl2在25℃、101kPa下完全反應。請根據上述信息回答下列有關問題:
(1)反應物斷鍵吸收的總能量為___。
(2)生成物成鍵放出的總能量為___。
(3)H2+Cl2![]() 2HCl是___(填“吸熱”或“放熱”)反應。
2HCl是___(填“吸熱”或“放熱”)反應。
(4)反應物的總能量___(填“>”或“<”)生成物的總能量。
(5)寫出鹽酸與氫氧化鋁反應的離子方程式__。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com