
【題目】圖Ⅰ、Ⅱ、Ⅲ是常見的氣體發生裝置;Ⅳ、Ⅴ、Ⅵ是氣體收集裝置,根據要求回答下列問題:



![]()


(1)若用MnO2與濃鹽酸反應制取氯氣,應選用裝置________,用方程式表示的制取氯氣的反應原理是___________________________。
(2)若用KMnO4與濃鹽酸反應制取氯氣,應選用的裝置________,
試完成并配平下列離子方程式:___MnO4-+____Cl-+____H+![]() ___Mn2++___Cl2↑+_____。
___Mn2++___Cl2↑+_____。
(3)若選用Ⅳ為氯氣的收集裝置,應該在試管口放置一團棉花,該棉花團應用________溶液浸濕,其作用是________。
(4)若選用Ⅴ為氯氣收集裝置,則氯氣應從________口通入.用化學方法檢驗氯氣收集滿了的方法是________。
【答案】 Ⅰ MnO2+4HCl![]() MnCl2+Cl2↑+2H2O Ⅲ 2 10 16 2 5 8H2O 氫氧化鈉 防止氯氣逸出污染空氣 A 將濕潤的淀粉KI試紙放在B口處,試紙變藍色,證明氯氣已集滿
MnCl2+Cl2↑+2H2O Ⅲ 2 10 16 2 5 8H2O 氫氧化鈉 防止氯氣逸出污染空氣 A 將濕潤的淀粉KI試紙放在B口處,試紙變藍色,證明氯氣已集滿
【解析】(1)二氧化錳和濃鹽酸的反應是固液混合加熱型,所以選擇Ⅰ裝置;在加熱條件下,二氧化錳和濃鹽酸反應生成氯化錳、氯氣和水,方程式為MnO2+4HCl![]() MnCl2+Cl2↑+2H2O;(2)KMnO4與濃鹽酸的反應是固液混合不需要加熱的,所以應選擇Ⅲ裝置;反應中MnO4-中錳元素的化合價是+7價,Mn2+的化合價是+2價,所以一個MnO4-生成Mn2+得5個電子,生成一個Cl2分子需要2個氯離子失去2個電子,所以得失電子的最小公倍數是10,再根據元素守恒知,生成物中還有水;所以該離子方程式中的計量數分別為:2、10、16、2、5、8H2O;(3)氯氣有毒,逸出會污染大氣,所以不能讓氯氣逸出;氯氣和水能反應是鹽酸和次氯酸,鹽酸和次氯酸是酸,都能和堿反應,所以可用氫氧化鈉溶液吸收氯氣;(4)氯氣的密度大于空氣的密度,所以應采用向上排空氣法收集氯氣,故A為進氣口;氯氣的氧化性大于碘的氧化性,所以氯氣能置換出碘化鉀中的碘,且碘遇淀粉變藍色,所以可用濕潤的淀粉KI試紙檢驗是否收集滿了氯氣,即將濕潤的淀粉KI試紙放在B口處,試紙變藍色,證明氯氣已集滿。
MnCl2+Cl2↑+2H2O;(2)KMnO4與濃鹽酸的反應是固液混合不需要加熱的,所以應選擇Ⅲ裝置;反應中MnO4-中錳元素的化合價是+7價,Mn2+的化合價是+2價,所以一個MnO4-生成Mn2+得5個電子,生成一個Cl2分子需要2個氯離子失去2個電子,所以得失電子的最小公倍數是10,再根據元素守恒知,生成物中還有水;所以該離子方程式中的計量數分別為:2、10、16、2、5、8H2O;(3)氯氣有毒,逸出會污染大氣,所以不能讓氯氣逸出;氯氣和水能反應是鹽酸和次氯酸,鹽酸和次氯酸是酸,都能和堿反應,所以可用氫氧化鈉溶液吸收氯氣;(4)氯氣的密度大于空氣的密度,所以應采用向上排空氣法收集氯氣,故A為進氣口;氯氣的氧化性大于碘的氧化性,所以氯氣能置換出碘化鉀中的碘,且碘遇淀粉變藍色,所以可用濕潤的淀粉KI試紙檢驗是否收集滿了氯氣,即將濕潤的淀粉KI試紙放在B口處,試紙變藍色,證明氯氣已集滿。


科目:高中化學 來源: 題型:
【題目】人口資源環境委員會副主任、中國科學院院士秦大河表示,當前情況下散燒煤和沒有清潔的煤是造成中國城市霧霾或者東部霧霾的主要原因。煤的氣化是解決霧霾,清潔地利用煤炭的重要途徑之一。
⑴已知:H2O(g)=H2O(I) △H=-44kJ/mol
物質 | H2(g) | C(s) | CO(g) |
燃燒熱kJ/mol | -285.8 | -393.5 | -283.0 |
①請寫出煤的氣化反應生成合成氣(CO和H2)的熱化學方程式___________。
②在恒溫、恒容的反應器中,能表明上述反應達到平衡狀態的是_______。
a.混合氣體平均相對分子質量不再改變
b.氣體壓強不再改變
c.各氣體濃度相等
d.反應體系中溫度保持不變
e.斷裂氫氧鍵速率是斷裂氫氫鍵速率的2倍
f.混合氣體密度不變
g.單位時間內,消耗水的質量與生成氫氣的質量比為9:1
⑵在催化劑作用下合成氣合成甲烷過程中會發生如下反應:
I CO(g)+3H2(g) = CH4(g)+H2O(g) △H1= -206 kJ/mol
II CO(g)+H2O(g) = CO2(g)+H2(g) △H2= -41 kJ/mol
Ⅲ 2CO(g)+2H2(g)= CH4(g)+CO2(g) △H 3= -247.4 kJ/mol
①圖1是太原理工大學煤化工研究所利用熱力學數據分析得到溫度對反應ⅠInK(化學平衡常數K的自然對數)的曲線圖,請分析出現這樣趨勢的原因是____________。
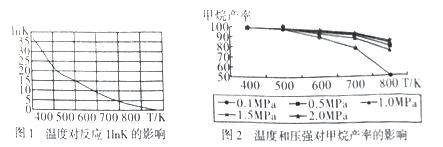
②提高甲烷反應選擇性的關鍵因素是_______,根據相關知識和圖2分析合成甲烷適宜的反應條件是
在550~630K,1MPa的原因是__________________。
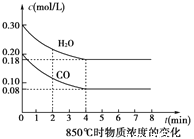
③850℃時在體積為5L反應器中發生反應Ⅱ,CO和H2O(g)濃度變化如圖所示,請列式計算此條件下的平衡常數_____________ 。
(3)CH4燃料電池利用率很高,裝置中添加1L2mol/L的KOH溶液為電解質,持續緩慢通入標準狀況下甲烷22.4L~33.6 L時負極電極反應為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究CO2的利用對促進低碳社會的構建具有重要意義。
(1)將CO2與焦炭作用生成CO,CO可用子煉鐵等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=akJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=bkJ·mol-1
則CO還原Fe2O3(s)的熱化學方程式為______________。
(2)將CO2轉化為甲醇的熱化學方程式為: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
取一定體積CO2和H2的混合氣體(物質的量之比為1∶3),加入恒容密閉容器中,發生上述反應。
①下列情況能說明反應已達平衡狀態的是________(填字母)。
A.容器內氣體密度不變 B.容器內氣體總壓強保持不變
C.絕熱恒容時,平衡常數不變 D.v正(CH3OH)=3v逆(H2)
②反應過程中測得甲醇的體積分數α(CH3OH)與反應溫度T的關系如圖所示,則該反應的ΔH______0(填“>”、“<”或“=”)。
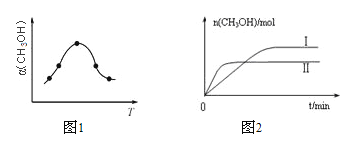
③在兩種不同條件下發生反應,測得CH3OH的物質的量隨時間變化如圖所示,曲線I、Ⅱ對應的平衡常數大小關系為KⅠ_____KⅡ(填“>”、“<”或“=”)。
(3)以CO2為原料還可以合成多種物質。
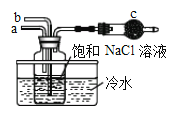
①如圖是模擬“侯氏制堿法”制取NaHCO3的部分裝置。操作中先在_____處通入NH3氣體,然后再在_______處通入CO2氣體。
②人工光合作用能夠借助太陽能用CO2和水制備化學原料,右圖是通過人工光合作用制備HCOOH的原理示意圖,請寫出催化劑b處的電極反應式:________________。
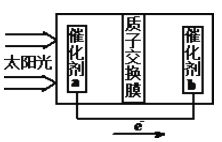
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由碳、氮、磷、硫等元素組成的蛋白質,在體內經過消化、吸收后,最后氧化成酸,對應的酸不正確的是( )
A. 碳→碳酸 B. 硫→硫酸 C. 氮→硝酸 D. 磷→磷酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制硝基苯的主要步驟如下
①配制一定比例的濃硫酸與濃硝酸的混合酸,加入反應器中;
②向室溫下的混合酸中逐滴加入一定量的苯,充分振蕩,混合均勻;
③在50~60℃下發生反應,直至反應結束;
④除去混合酸后,粗產品依次用蒸餾水和5%的NaOH溶液洗滌,最后再用蒸餾水洗滌;
⑤將用無水CaCl2干燥后的粗硝基苯進行蒸餾,得到純硝基苯。
請回答下列問題:
(1)配制一定比例濃硫酸與濃硝酸混合酸時,操作注意事項是___________。
(2)步驟③中,為了使反應在50~60℃下進行,常用的方法是____________。
(3)步驟④中洗滌粗硝基苯使用的儀器是_____________。
(4)步驟④中粗產品用5%的NaOH溶液洗滌的目的是__________________。
(5)寫出制硝基苯的方程式________。純硝基苯是無色、密度比水_____(填“小”或“大”),具有________氣味的油狀液體。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下發生反應:2A(g)+2B(g)![]() xC(g)+2D(g),在2L密閉容器中,把4molA和2molB混合,2min后達到平衡時生成1.6molC,又測得反應速率VD=0.2mol/(Lmin),下列說法正確的是( )
xC(g)+2D(g),在2L密閉容器中,把4molA和2molB混合,2min后達到平衡時生成1.6molC,又測得反應速率VD=0.2mol/(Lmin),下列說法正確的是( )
A. A和B的轉化率均是20% B. x=4
C. 平衡時A的物質的量為2.8mol D. 平衡時氣體壓強比原來減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述涉及的化學相關知識,其中說法正確的是( )
A.植物油可以作為萃取劑分離出碘水中的碘
B.石油的分餾、煤的氣化、海水制鎂都包括化學變化
C.處理廢水時加入明礬作為消毒劑,可以除去水中的雜質
D.乙烯、甲烷、SO2三種無色氣體可用溴水鑒別
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com