
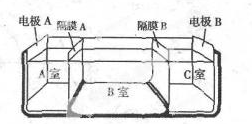
 水是一種重要的自然資源,是人類賴以生存不可缺少的物質.請回答下列問題:
水是一種重要的自然資源,是人類賴以生存不可缺少的物質.請回答下列問題:分析 (1)混凝劑是溶液中水解生成膠體的鹽類,凈水作用是吸附懸浮雜質使其聚沉達到凈化目的;
(2)凈化水是除去懸浮雜質,軟化水是除去鈣鎂離子;
(3)依據硬度為1°的水是指每升水含10mgCaO或與之相當的物質(如7.1mgMgO),將水中的Ca2+、Mg2+質量折算成CaO的質量計算得到;
(4)硬水軟化需要把鈣離子和鎂離子全部沉淀,加入氫氧化鈣和鎂離子、碳酸氫根離子反應,加入碳酸鈉沉淀鈣離子.;
(5)陰離子交換膜只允許陰離子自由通過,陽離子交換膜只允許陽離子自由通過;電解池的陰極是氫離子放電,陽極是氫氧根離子放電;根據電極反應來書寫總的電解反應.
解答 解:(1)混凝劑是吸附水中的微小懸浮顆粒,凝聚成較大的顆粒,而快速沉降的主要作用,要具備水解生成膠體的性質,所以常有鋁鹽或鐵鹽在水中發生水解生成相應氫氧化物膠體,如明礬,鋁離子水解生成氫氧化鋁膠體和氫離子,氫氧化鋁膠體具有吸附性,所以能凈水,水解方程式為Al3++3H2O?Al(OH)3+3H+,明礬,硫酸鋁,硫酸鐵,硫酸亞鐵也可以起到凈水的作用,鋁鹽或鐵鹽在水中發生水解生成相應的氫氧化物膠體,它可吸附天然水中懸浮物并破壞天然水中的其他帶異電的膠體,使其聚沉達到凈水的目的;
故答案為:明礬(硫酸鋁,硫酸鐵,硫酸亞鐵);鋁鹽或鐵鹽在水中發生水解生成相應的氫氧化物膠體,它可吸附天然水中懸浮物并破壞天然水中的其他帶異電的膠體,使其聚沉達到凈水的目的;
(2)水的凈化是除去懸浮性雜質,一般用明礬進行;水的軟化是降低Ca2+、Mg2+的濃度,方法很多,有離子交換法、石灰純堿法等,
故答案為:水的凈化是用混凝劑(如明礬等)將水中膠體及懸浮物沉淀下來,而水的軟化是除去水中的鈣離子和鎂離子;
(3)某天然水中c(Ca2+)=1.2×10-3mol•L-1,c(Mg2+)=6×10-4mol•L-1,硬度為1°的水是指每升水含10mgCaO或與之相當的物質(如7.1mgMgO);1L水中鈣離子物質的量=1.2×10-3mol,相當于CaO質量=1.2×10-3mol×56g/mol=67.2mg,1L水中鎂離子物質的量=6×10-4mol,相當于氧化鎂質量6×10-4mol×40g/mol=24mg,所以水的硬度=$\frac{67.2mg}{10mg}$+$\frac{24mg}{7.1mg}$=10°;
故答案為:10°;
(4)10m3這種天然水水中含有鈣離子物質的量=10×103L×1.2×10-3mol•L-1=12mol;鎂離子物質的量=10×103L×6×10-4mol•L-1=6mol;碳酸氫根離子物質的量=10×103L×8×10-4mol•L-1=8mol;加入氫氧化鈣發生的反應為:
Mg2++2OH-=Mg(OH)2↓ HCO3-+OH-=CO32-+H2O
1 2 1 1 1
6mol 12mol 8mol 8mol 8mol
共需氫氧根物質的量20mol;
需要Ca(OH)2物質的量10mol,氫氧化鈣質量為74g/mol×10mol=740g,
水溶液中Ca2+物質的量為12mol+10mol=22mol,
其中需要加入的 碳酸根離子為22mol-8mol=14mol,需要碳酸鈉的質量為14mol×106g/mol=1484g,
故答案為:740;1484;
(5)①電解池的陰極是氫離子放電,陽極是氫氧根離子放電,隔膜A是陰離子交換膜,隔膜C是陽離子交換膜,故答案為:陰;
②電解池的陰極是氫離子放電,陽極是氫氧根離子放電,隔膜A是陰離子交換膜,隔膜C是陽離子交換膜,則導致A室顯酸性,B室顯中性,C室顯堿性,所以pH大小順序為:pHa<pHb<pHc,故答案為:pHa<pHb<pHc.
點評 本題考查了鹽類水解的應用,凈水方法和軟化原理,水的硬度計算需要理解題干信息,準確計算,題目難度中等.


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:選擇題
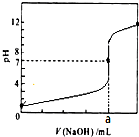 常溫下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲線,如圖所示.下列說法不正確的是( )
常溫下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲線,如圖所示.下列說法不正確的是( )| A. | a=20.00 | |
| B. | 滴定過程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-) | |
| C. | 若用酚酞作指示劑,當滴定到溶液明顯由無色變為紅色時停止滴定 | |
| D. | 若將鹽酸換成同濃度的醋酸,則滴定到pH=7時,a<20.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 參加反應所需NaOH與氯氣的物質的量之比一定為2:1 | |
| B. | 反應體系中n(NaCl):n(NaClO):n(NaC1O3)(物質的量之比)可能為11:1:2 | |
| C. | 若反應有amol氯氣參加反應,則amol<轉移電子數<$\frac{5a}{3}$mol | |
| D. | 反應中NaC1O和NaClO3為氧化產物,且物質的量之比一定為l:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 此純堿溶液中含有CO${\;}_{3}^{2-}$的數目為aNA | |
| B. | 若a<b<2a,生成標準狀況下二氧化碳的體積可能是11.2b L或22.4(b-a)L | |
| C. | 若b≥2a,則兩溶液相互滴加的順序不同,反應生成的二氧化碳分子數目不同 | |
| D. | 若b≤a,則無論兩溶液相互滴有加的順序如何,反應過程中均有氣泡產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
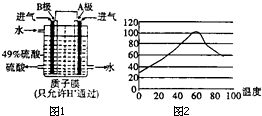 我國黃鐵礦(主要成分:FeS2、SiO2)儲量豐富,目前主要利用黃鐵礦資源生產硫酸等無機化工產品.
我國黃鐵礦(主要成分:FeS2、SiO2)儲量豐富,目前主要利用黃鐵礦資源生產硫酸等無機化工產品. ①燒渣用稀硫酸浸取時有單質硫生成,生成單質硫的一步化學反應方程式為H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
①燒渣用稀硫酸浸取時有單質硫生成,生成單質硫的一步化學反應方程式為H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 甲是乙烯 | B. | 乙可能是葡萄糖 | ||
| C. | 丙與NaOH溶液反應不能生成乙醇 | D. | 丁十H2→乙醇的反應屬于加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 其他條件不變,增大壓強,平衡不發生移動 | |
| B. | 其他條件不變,增大壓強,混合氣體的總質量不變 | |
| C. | 該反應式中n值一定為2 | |
| D. | 原混合氣體中A與B的物質的量之比為2:1,且2M(A)+M(B)=3M(D)(其中M表示物質的摩爾質量) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲烷、苯、乙醇和乙酸在一定條件下都能發生取代反應 | |
| B. | 乙烯能使酸性高錳酸鉀溶液和溴水褪色,二者反應原理相同 | |
| C. | 糖類、油脂和蛋白質都是高分子化合物,都能發生水解反應 | |
| D. | 蛋白質、人造纖維和光導纖維都屬于有機高分子化合物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com