
| A. | SO2被酸性高錳酸鉀吸收:MnO4-+SO2+4H+═Mn2++SO42-+2H2O | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至剛好沉淀完全:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 氯化鎂溶液中加入足量濃氨水 Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | Fe3O4與稀硝酸的反應:Fe3O4+8H+═Fe2++2Fe3++4H2O |
分析 A.離子方程式兩邊總電荷不相等,違反了電荷守恒;
B.沉淀剛好完全時氫氧化鋇與硫酸氫銨按照物質的量1:1反應,漏掉了銨根離子與氫氧根離子的反應;
C.氯化鎂與濃氨水反應生成氫氧化鎂沉淀和氯化銨;
D.稀硝酸具有強氧化性,能夠氧化亞鐵離子.
解答 解:A.SO2被酸性高錳酸鉀吸收,二者發生氧化還原反應,正確的離子方程式為:2MnO4-+3SO2+4H+═2Mn2++3SO42-+2H2O,故A錯誤;
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至剛好沉淀完全,硫酸氫銨中銨根離子和氫離子都完全反應,正確的離子方程式為:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+H2O+NH3•H2O,故B錯誤;
C.氯化鎂溶液中加入足量濃氨水,反應生成氫氧化鎂沉淀,反應的離子方程式為:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+,故C正確;
D.Fe3O4與稀硝酸發生氧化還原反應,正確的離子方程式為:3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故D錯誤;
故選C.
點評 本題考查了離子方程式的正誤判斷,為高考的高頻題,屬于中等難度的試題,注意明確離子方程式正誤判斷常用方法:檢查反應物、生成物是否正確,檢查各物質拆分是否正確,如難溶物、弱電解質等需要保留化學式,檢查是否符合守恒關系(如:質量守恒和電荷守恒等)、檢查是否符合原化學方程式等.


 陽光考場單元測試卷系列答案
陽光考場單元測試卷系列答案 名校聯盟沖刺卷系列答案
名校聯盟沖刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化學 來源: 題型:選擇題
| A. | 水庫的鋼閘門接直流電源的正極,可以減緩閘門的腐蝕 | |
| B. | 加入少量硫酸銅可加快鋅與稀硫酸的反應速率,說明Cu2+具有催化作用 | |
| C. | H2O2分解產生標準狀況下22.4 L O2,理論上轉移電子數約為4×6.02×1023 | |
| D. | 常溫下pH=3的鹽酸與pH=11的某堿溶液等體積混合,若溶液呈堿性,該堿為弱堿 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 操作 | 現象 | 結論 | |
| A | 先滴加BaCl2溶液,再加稀HNO3 | 生成白色沉淀,且沉淀不溶解 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振蕩、靜置 | 下層溶液顯紫紅色 | 原溶液中有I- |
| C | 用潔凈鉑絲蘸取溶液進行焰色反應 | 火焰呈黃色 | 原溶液中有Na+、K+ |
| D | 滴加NaOH溶液加熱,將紅色石蕊試紙置于試管口 | 試紙不變藍 | 原溶液中無NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | ||
| Y | Z | W |
| T |
| A. | Y的最高價氧化物的水化物具有兩性 | |
| B. | Z的最高價氧化物常溫常壓下為固體 | |
| C. | 氣態氫化物的穩定性:X>W>Z | |
| D. | 原子半徑:W>Z>Y |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
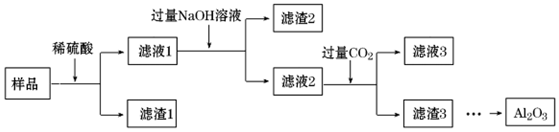
| A. | 濾渣1 的主要成分為SiO2 | |
| B. | 可用KSCN溶液檢驗濾液1中的Fe 3+ | |
| C. | 濾液2為純凈的Na AlO2溶液 | |
| D. | 將濾渣3 洗滌、干燥、灼燒,可以得到Al2O3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
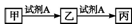
| A. | 若A為氯水,X為金屬元素,則甲與丙反應可生成乙 | |
| B. | 若A為金屬單質,乙的水溶液遇KSCN溶液變紅,則甲可能為非金屬單質 | |
| C. | 若A為氧氣,丙在通常狀況下為紅棕色氣體,則甲一定為非金屬單質 | |
| D. | 若A為NaOH溶液,X為短周期的金屬元素,則乙一定為白色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同壓強、同體積的N2O和CO2 | B. | 同體積、同密度的C2H4和C3H6 | ||
| C. | 同溫度、同體積的H2和N2 | D. | 同體積、不同密度的N2和CO |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
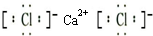 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com