
分析 (1)過氧化氫分解生成氧氣和水;
(2)一氧化碳還原氧化鐵生成鐵和二氧化碳;
(3)二氧化碳使澄清石灰水變渾濁,反應生成碳酸鈣沉淀和水;
(4)碳酸鈉和鹽酸反應生成氯化鈉和水、二氧化碳;
(5)氯化鈉和硝酸銀溶液反應生成氯化銀沉淀和硝酸鈉;
(6)鹽酸和氫氧化鐵反應生成氯化鐵和水.
解答 解:(1)過氧化氫分解生成氧氣和水,方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
故答案為:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)一氧化碳還原氧化鐵生成鐵和二氧化碳,方程式:Fe2O3+3CO$\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO2;
故答案為:Fe2O3+3CO$\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO2;
(3)二氧化碳使澄清石灰水變渾濁,反應生成碳酸鈣沉淀和水,方程式:Ca(OH)2+CO2=CaCO3↓+H2O,
故答案為:Ca(OH)2+CO2=CaCO3↓+H2O;
(4)碳酸鈉和鹽酸反應生成氯化鈉和水、二氧化碳,方程式:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
故答案為:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(5)氯化鈉和硝酸銀溶液反應生成氯化銀沉淀和硝酸鈉,化學方程式:AgNO3+NaCl═AgCl+NaNO3;
故答案為:AgNO3+NaCl═AgCl+NaNO3;
(6)鹽酸和氫氧化鐵反應生成氯化鐵和水,化學方程式:3HCl+Fe(OH)3=FeCl3+3H2O;
故答案為:3HCl+Fe(OH)3=FeCl3+3H2O;
點評 本題難度不大,考查學生根據(jù)反應原理書寫化學方程式的能力,化學方程式書寫經常出現(xiàn)的錯誤有不符合客觀事實、不遵守質量守恒定律、不寫條件、不標符號等.


科目:高中化學 來源: 題型:選擇題
| A. | 向NaOH溶液中加入少量Mg(HCO3)2溶液:2OH-+Mg2+═Mg(OH)2↓ | |
| B. | 向足量NaHSO4溶液中逐漸滴入Ba(HCO3)2溶液:2HCO3-+Ba2++2H++SO42-═BaSO4↓+2H2O+2CO2↑ | |
| C. | 酸性KMnO4溶液與H2O2反應:2MnO4-+10H++3H2O2═2Mn2++3O2↑+8H2O | |
| D. | 向Fe(NO3)3溶液中加入過量HI溶液:2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液中可能存在Mg2+和Fe3+ | B. | 溶液中可能存在Br-和Cl- | ||
| C. | 溶液可能存在Ba2+和Cl- | D. | 溶液中一定存在Na+和CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
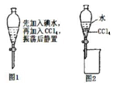
| A. | 從碘水中提取單質碘時,不能用無水乙醇代替四氯化碳 | |
| B. | 進行如圖1操作后,實驗現(xiàn)象為液體分層,下層呈無色 | |
| C. | 利用如圖2裝置可以分離四氯化碳和水 | |
| D. | 在這個操作中,應選擇有機萃取劑,且萃取劑不溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 得電子越多,其氧化性越強 | B. | 分子中一定含有氧元素 | ||
| C. | 在反應中易失電子的物質 | D. | 在反應中易結合電子的物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
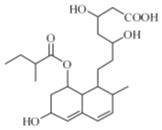
| A. | 能與FeCl3 溶液發(fā)生顯色反應 | |
| B. | 能使酸性KMnO4 溶液褪色 | |
| C. | 能發(fā)生加成、取代、消去反應 | |
| D. | 1mol該物質最多可消耗4molNaOH、2molBr2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在標況下,22.4LSO3和22.4LC2H4原子個數(shù)比為2:3 | |
| B. | 將78gNa2O2與過量CO2反應轉移的電子數(shù)為2NA | |
| C. | 28g乙烯分子中含有極性共價鍵的數(shù)目為6NA | |
| D. | 1molNaCl晶體中含有NA個Na+ |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com