
【題目】尼美舒利是一種非甾體抗炎藥,它的一種合成路線如下:

已知:
回答下列問題:
(1)A的化學名稱為___________。
(2)B的結構簡式為___________。
(3)由C生成D的化學方程式為___________,E→F的反應類型為___________。
(4)C中的官能團有___________、___________(填官能團名稱)。
(5)由甲苯為原料可經三步合成2,4,6-三氨基苯甲酸,合成路線如下:

反應①的試劑和條件為___________;中間體B的結構簡式為___________;反應③試劑和條件為___________。
(6)E的同分異構體中能同時滿足下列條件的共有___________種(不含立體異構);
①含有兩個苯環且兩個苯環直接相連
②能與FeCl3溶液發生顯色反應
③兩個取代基不在同一苯環上
其中核磁共振氫譜為6組峰,峰面積比為2︰2︰2︰2︰2︰1的結構簡式為___________。
【答案】苯 ![]()
 取代反應 溴原子 硝基 濃硝酸/濃硫酸,加熱
取代反應 溴原子 硝基 濃硝酸/濃硫酸,加熱  H2,雷尼鎳 9
H2,雷尼鎳 9 
【解析】
運用逆合成法根據合成路線及反應條件等題干信息分析各有機物的組成,書寫相關方程式;根據限制條件判斷同分異構體的種類及寫出相關結構簡式。
運用逆合成法,根據反應條件及題干信息分析知,F為 ,E為
,E為 ,D為
,D為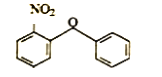 ,C為
,C為 ,B為
,B為![]() ,A為苯;
,A為苯;
(1)A的化學名稱為苯,
故答案為:苯;
(2)B為苯與溴發生的取代反應,的結構簡式為![]() ,
,
故答案為:![]() ;
;
(3)根據上述分析,C生成D的化學方程式為 ;E→F的反應類型為取代反應,
;E→F的反應類型為取代反應,
故答案為: ;取代反應;
;取代反應;
(4)C為 ,其中官能團有溴原子;硝基,
,其中官能團有溴原子;硝基,
故答案為:溴原子;硝基;
(5)反應①為硝化反應,試劑和條件為濃硝酸/濃硫酸,加熱;中間體B為三硝基苯甲酸,結構簡式為 ;反應③為硝基被還原,根基題干信息知反應試劑和條件為H2,雷尼鎳,
;反應③為硝基被還原,根基題干信息知反應試劑和條件為H2,雷尼鎳,
故答案為:濃硝酸/濃硫酸,加熱; ;H2,雷尼鎳;
;H2,雷尼鎳;
(6)能與FeCl3溶液發生顯色反應,說明結構中含有酚羥基,則另一個取代基為氨基,兩個苯環直接相連,以直接相連的兩個碳原子為準,與之向鄰的碳原子兩邊各有2個,與之相間的碳原子兩邊各有2個,與之相對的碳原子兩邊各有1個,若羥基在其中一個苯環的鄰位上,則氨基在另一苯環上的位置有鄰位、間位和對位3種,若羥基在間位,則氨基也有3種,若羥基在對位,氨基也有3種情況,所以同分異構體一共有3+3+3=9種;其中根據對稱性滿足核磁共振氫譜的結構為: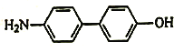 ,
,
故答案為:. 9; 。
。


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:
【題目】如圖裝置中,U形管內為紅墨水,a、b試管內分別盛有食鹽水和氯化銨溶液(呈酸性),各加入生鐵塊,放置一段時間。下列有關描述錯誤的是( )

A. 生鐵塊中的碳是原電池的正極
B. 紅墨水柱兩邊的液面變為左低右高
C. 兩試管中相同的電極反應式是:Fe →Fe2++2e-
D. a試管中發生了吸氧腐蝕,b試管中發生了析氫腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向25℃時,體積均為20mL濃度均為0.1mol·L-1的兩種酸HX、HY溶液中分別滴加0.1mol·L-1的NaOH溶液所加NaOH溶液體積與反應后溶液的pH的關系如圖所示。下列敘述正確的是

A. HX、HY均為弱酸
B. Ka(HY)的數量級約為10-6
C. b點時:2c(Na+)=c(Y-)+c(HY)
D. V(NaOH)=20mL時,反應后的兩種溶液中c(X-)=c(Y-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種三室微生物燃料電池污水凈化系統原理如圖所示,圖中有機廢水中有機物可用C6H10O5,表示,咸水中的主要溶質為NaCl。下列有關說法正確的是

A. a為原電池的負極
B. b電極附近溶液的pH減小
C. a電極反應式為![]()
D. 中間室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】重鉻酸鈉是一種用途極廣的強氧化劑,工業上可以用鉻鐵礦[主要成分為Fe(CrO2)2或FeO·Cr2O3,還含有Al2O3、Fe2O3、SiO2等雜質]制備,其主要工藝流程如圖所示。請回答下列問題:

(1)煅燒鉻鐵礦生成Na2CrO4的化學方程式為______________________。
(2)調節溶液的pH所選的試劑為___________(填名稱),寫出生成Al(OH)3的化學方程式______________________。
(3)Na2CrO4溶液酸化時發生反應2CrO42-(黃色)+2H+![]() Cr2O72-(橙紅色)+H2O。
Cr2O72-(橙紅色)+H2O。
①該反應___________氧化還原反應(填“是”或“不是”),反應的平衡常數表達式:K=___________。
②若向Na2Cr2O7溶液(橙紅色)中加入足量的NaOH固體,溶液___________(填標號)
A 變黃色 B 顏色不變 C 變紅色溶液
③已知:25℃時,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7,的Ksp=2×10-7。25℃時,向Na2Cr2O7溶液中加入AgNO3溶液,生成磚紅色沉淀,且溶液酸性增強,該沉淀的化學式是___________。
(4)用重鉻酸鈉(Na2Cr2O7)結晶后的母液生產重鉻酸鉀的反應為Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,結合溶解度圖回答,冷卻結晶析出大量K2Cr2O7的原因是___________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校學生課外活動小組的同學設計下圖所示實驗裝置,用來驗證一氧化碳具有還原性,回答下列問題:

(1)寫出裝置A中所發生反應的離子方程式:__________。
(2)裝置B中最適宜的試劑是_________________。
(3)若實驗中沒有裝置C,使裝置B與裝置D直接相連,會對實驗造成的影響是_______。
(4)根據實驗中的___________________現象,可證明CO具有還原性。
(5)若要根據裝置F中澄清石灰水變渾濁的現象確認一氧化碳具有還原性,應在上圖裝置________與______之間連接下圖中的________裝置(填序號)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列四個反應
①2Na+2H2O=2NaOH+H2↑ ②2F2+2H2O=4HF+O2
③Cl2+H2O=HCl+HClO ④C+H2O(g)![]() CO+H2
CO+H2
試從氧化還原的角度,回答下列問題:
(1)水只作還原劑的是__________________(填序號)
(2)二氧化氯(ClO2)是一種在水處理方面有廣泛應用的高效安全消毒劑,而且不會產生對人體有潛在危害的物質。工業上可以用如下方法制備ClO2:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O。反應中氧化劑是____________,生成1.25mol氧化產物共轉移電子_________mol。寫出該反應的離子方程式_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋼材在社會發展中應用廣泛。為研究某種碳索鋼(含少量碳和硫)的成分,科研小組進行了如下探究活動。
稱取碳素鋼(已除表面氧化物)24.0g放入耐高溫反應管中與O2反應,除去未反應的O2,收集到干燥混合氣體X 1.12L(已折算成標準狀況下的體積)。
(1)科研小組用下圖所示實驗裝置檢驗混合氣體X的組成。

①裝置B中的試劑是___________,裝置C的作用是_________。
②若觀察到________(填實驗現象),證明X中含有CO。
(2)反應后,耐高溫反應管內固體中除含有Fe3+之外,還可能含有Fe2+。要確定其中的Fe2+,可選用_______(填序號)。
a.KSCN溶液和氯水 b.KSCN溶液和鐵粉
c.稀鹽酸和K3[Fe(CN)6]溶液 d.稀H2SO4和KMnO4溶液
(3)科研小組用下圖所示裝置(部分)測定SO2的體積分數,并計算碳素鋼的含碳量。將氣體X緩慢通過實驗裝置,當觀察到_____(填實驗現象)時,停止通氣,此時氣體流量儀顯示的流量為112mL(已換算成標準狀況)。則氣體X中SO2的體積分數為_____,碳素鋼中碳元素的質量分數為_________(保留1位小數)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗小組探究鋁片做電極材料時的原電池反應,實驗如下:
① | ② | ③ |
|
|
煮沸冷卻后的溶液 |
電流計指針向右偏轉,鎂片、鋁片表面產生無色氣泡 | 電流計指針迅速向右偏轉,逐漸向零刻度恢復,經零刻度后繼續向左偏轉;鎂片表面開始時無明顯現象,一段時間后有少量氣泡逸出;鋁片表面持續有氣泡逸出。 | 電流計指針向左偏轉。鋁片表面有氣泡逸出,銅片沒有明顯現象;約3分鐘后,銅片表面有少量氣泡產生,鋁片表面氣泡略有減少。 |
下列說法不正確的是
A. 實驗①中,鎂片做原電池的負極
B. 實驗②中,初始時的實驗現象對應的原電池反應為:2Mg + O2 + 2H2O ![]() 2Mg( OH) 2
2Mg( OH) 2
C. 實驗②中,一段時間后,鋁片發生的電極反應式為:Al - 3 e - ![]() Al 3+
Al 3+
D. 實驗① ~ ③可推知,鋁片做電極材料時的原電池反應與另一個電極的電極材料、溶液的酸堿性、溶液中溶解的O2等因素有關
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com