
【題目】如圖所示的電解池Ⅰ和Ⅱ中,a、b、c和d均為Pt電極。電解過程中,電極b和d上
沒有氣體逸出,但質量均增大,且增重b>d。符合上述實驗結果的鹽溶液是

選項 | X | Y |
A | MgSO4 | CuSO4 |
B | AgNO3 | Pb(NO3)2 |
C | FeSO4 | Al2 (SO4)3 |
D | CuSO4 | AgNO3 |
A. A B. B C. C D. D
【答案】B
【解析】
試題電極b、d均為陰極,在它們上面均沒有氣體逸出,但質量均增大,且增重b>d,則所電解的鹽溶液中金屬元素應該在金屬活動順序表中(H)以后,轉移相同電子時,b析出金屬質量大于d.陽離子得電子能力如圖所示:
![]() ,前面的H+表示酸溶液中的H+,后面的H+表示鹽溶液中的H+.A.在金屬活動性順序表中,Mg在H之前,所以電解鎂鹽溶液時陰極上不能得到金屬單質,故A錯誤;B.由陽離子得電子能力順序表可以看出,鹽溶液中Ag+的得電子能力大于H+,K+小于H+,因此電解硝酸銀溶液時陰極b電極上生成Ag、電解硝酸鉀溶液陰極d上生成H2,兩池中的電極上轉移的電子是相等的,設轉移2mol電子,b增重216g,d極生成2gH2,增重0g,所以質量增加b>d,故B錯誤;C.在金屬活動性順序表中,Fe、Al都在H之前,電解亞鐵鹽、鋁溶液溶液時陰極上都不能得到金屬單質,故C錯誤;D.兩池中的電極上轉移的電子是相等的,設轉移2mol電子,b增重64g,d增重216g,所以質量增加b<d,故D正確;故選D。
,前面的H+表示酸溶液中的H+,后面的H+表示鹽溶液中的H+.A.在金屬活動性順序表中,Mg在H之前,所以電解鎂鹽溶液時陰極上不能得到金屬單質,故A錯誤;B.由陽離子得電子能力順序表可以看出,鹽溶液中Ag+的得電子能力大于H+,K+小于H+,因此電解硝酸銀溶液時陰極b電極上生成Ag、電解硝酸鉀溶液陰極d上生成H2,兩池中的電極上轉移的電子是相等的,設轉移2mol電子,b增重216g,d極生成2gH2,增重0g,所以質量增加b>d,故B錯誤;C.在金屬活動性順序表中,Fe、Al都在H之前,電解亞鐵鹽、鋁溶液溶液時陰極上都不能得到金屬單質,故C錯誤;D.兩池中的電極上轉移的電子是相等的,設轉移2mol電子,b增重64g,d增重216g,所以質量增加b<d,故D正確;故選D。


 七星圖書口算速算天天練系列答案
七星圖書口算速算天天練系列答案 初中學業考試導與練系列答案
初中學業考試導與練系列答案科目:高中化學 來源: 題型:
【題目】一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應:C(s)+CO2(g)![]() 2CO(g)。平衡時,體系中氣體體積分數與溫度的關系如下圖所示:
2CO(g)。平衡時,體系中氣體體積分數與溫度的關系如下圖所示:

已知:氣體分壓(P分)=氣體總壓(P總)×體積分數。下列說法正確的是
A. 550℃時,若充入惰性氣體,正,逆 均減小,平衡不移動
B. 650℃時,反應達平衡后CO2的轉化率為25.0%
C. T℃時,若充入等體積的CO2和CO,平衡向逆反應方向移動
D. 925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數KP=24.0P總
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用甲烷與氯氣發生取代反應制取副產品鹽酸的設想在工業上已成為現實。某化學興趣小組通過在實驗室中模擬上述過程,其設計的模擬裝置如下:
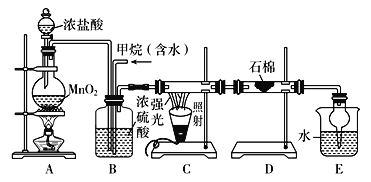
根據設計要求回答:
(1)B裝置有三種功能:①控制氣流速度; ②均勻混合氣體; ③____________。
(2)設![]() =x,若理論上欲獲得最多的氯化氫,則x取值范圍________。
=x,若理論上欲獲得最多的氯化氫,則x取值范圍________。
(3)D裝置的石棉中均勻混有KI粉末,其作用是______________。
(4)E裝置的作用是________(填編號)。
A 收集氣體 B 吸收氯氣
C 防止倒吸 D 吸收氯化氫
(5)在C裝置中,經過一段時間的強光照射,發現硬質玻璃管內壁有黑色小顆粒產生,寫出置換出黑色小顆粒的化學方程式:_______________________________________。
(6)E裝置中除生成鹽酸外,還含有有機物,從E中分離出有機物的最佳方法為________。該裝置還有缺陷,原因是沒有進行尾氣處理,其尾氣主要成分為________(填編號)。
a CH4 b CH3Cl c CH2Cl2 d CHCl3 e CCl4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列元素的原子半徑
原子 | N | S | O | Si |
半徑/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根據以上數據,磷原子的半徑可能是
A.0.80×10-10mB.1.10×10-10mC.1.20×10-10mD.0.70×10-10m
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環境中常見的重金屬污染物有汞、鉛、錳、鉻、鎘。處理工業廢水中含有的![]() 和
和![]() 常用的方法是還原沉淀法,該法的工藝流程為
常用的方法是還原沉淀法,該法的工藝流程為![]()
![]()
![]()
![]() Cr3+
Cr3+![]() Cr(OH)3。
Cr(OH)3。
其中第①步存在平衡:2![]() (黃色)+2H+
(黃色)+2H+![]()
![]() (橙色)+H2O。
(橙色)+H2O。
(1)寫出第①步反應的平衡常數表達式:_________________________________。
(2)關于第①步反應,下列說法正確的是________(填序號)。
A.通過測定溶液的pH可以判斷反應是否已達到平衡狀態
B.該反應為氧化還原反應
C.在強酸性環境下,溶液的顏色為橙色
(3)第②步反應中,還原0.1 mol![]() ,需要________mol FeSO4·7H2O。
,需要________mol FeSO4·7H2O。
(4)第③步反應除生成Cr(OH)3沉淀外,還可能生成的沉淀為________。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。常溫下,Cr(OH)3的溶度積常數Ksp=10-32,當溶液中Cr3+的濃度降至10-5mol·L-1,認為Cr3+已經完全沉淀。現將第③步反應后溶液的pH調至4,請通過計算說明Cr3+是否沉淀完全(請寫出計算過程)。____________
Cr3+(aq)+3OH-(aq)。常溫下,Cr(OH)3的溶度積常數Ksp=10-32,當溶液中Cr3+的濃度降至10-5mol·L-1,認為Cr3+已經完全沉淀。現將第③步反應后溶液的pH調至4,請通過計算說明Cr3+是否沉淀完全(請寫出計算過程)。____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在元素周期表中位于金屬元素和非金屬元素交界處最容易找到的材料是( )
A.半導體材料
B.耐高溫、耐腐蝕的合金材料
C.制農藥的材料
D.制催化劑的材料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,達到平衡后呈紅色。再將混合液分為5份,分別進行如下實驗:
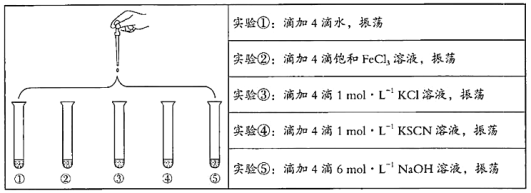
下列說法不正確的是
A. 對比實驗①和②,為了證明增加反應物濃度,平衡發生正向移動
B. 對比實驗①和③,為了證明增加反應物濃度,平衡發生逆向移動
C. 對比實驗①和④,為了證明增加反應物濃度,平衡發生正向移動
D. 對比實驗①和⑤,為了證明減少反應物濃度,平衡發生逆向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丁烯(C4H8)是制備線性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脫氫制備,C4H10(g)![]() C4H8(g)+H2(g)
C4H8(g)+H2(g) ![]() H=+123kJ·mol-1。該工藝過程中生成的副產物有炭(C)、C2H6、C2H4、C4H6等。進料比[
H=+123kJ·mol-1。該工藝過程中生成的副產物有炭(C)、C2H6、C2H4、C4H6等。進料比[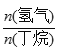 ]和溫度對丁烯產率的影響如圖1、圖2所示。已知原料氣中氫氣的作用是活化固體催化劑。
]和溫度對丁烯產率的影響如圖1、圖2所示。已知原料氣中氫氣的作用是活化固體催化劑。
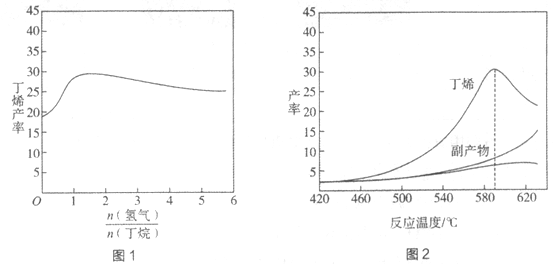
下列分析正確的是
A. 氫氣的作用是活化固體催化劑,改變氫氣量不會影響丁烯的產率
B. 丁烷催化脫氫是吸熱反應,丁烯的產率隨溫度升高而不斷增大
C. 隨溫度升高丁烯裂解生成的副產物增多,會影響丁烯的產率
D. 一定溫度下,控制進料比[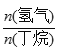 ]越小,越有利于提高丁烯的產率
]越小,越有利于提高丁烯的產率
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com