
 T℃時,在一個體積為2L的容器中,A氣體與B氣體反應生成C氣體,反應過程中A、B、C濃度變化如圖所示.
T℃時,在一個體積為2L的容器中,A氣體與B氣體反應生成C氣體,反應過程中A、B、C濃度變化如圖所示.分析 (1)由圖可知,A、B的物質的量濃度減小,C的濃度增加,則A、B為反應物,C為生成物,濃度變化量之比為(2.4-1.6):(1.6-1.2):(0.4-0)=2:1:1,t1時達到平衡狀態;
(2)結合v=$\frac{△c}{△t}$計算;
(3)轉化的B為0.4mol/L,開始的B為1.6mol/L;
(4)K(300℃)<K(350℃),可知溫度越高,K越大,則升高溫度平衡正向移動;
(5)恒容條件下,下列措施中能使$\frac{n(A)}{n(C)}$降低,則使平衡正向移動.
解答 解:(1)由圖可知,A、B的物質的量濃度減小,C的濃度增加,則A、B為反應物,C為生成物,濃度變化量之比為(2.4-1.6):(1.6-1.2):(0.4-0)=2:1:1,t1時達到平衡狀態,由速率之比等于化學計量數之比可知反應為2A(g)+B(g)?C(g),
故答案為:2A(g)+B(g)?C(g);
(2)0~4分鐘期間,B的平均反應速率為$\frac{1.6mol/L-1.4mol/L}{4min}$=0.05 mol/(L•min),
故答案為:0.05 mol/(L•min);
(3)轉化的B為0.4mol/L,開始的B為1.6mol/L,則B的轉化率為$\frac{0.4}{1.6}$×100%=25%,
故答案為:25%;
(4)K(300℃)<K(350℃),可知溫度越高,K越大,則升高溫度平衡正向移動,則正反應為吸熱反應,
故答案為:吸;
(5)恒容條件下,下列措施中能使$\frac{n(A)}{n(C)}$降低,則使平衡正向移動,
a.充入氦氣,平衡不移動,故不選;
b.降低溫度,平衡逆向移動,故不選;
c.使用催化劑,平衡不移動,故不選;
d.再充入2.4mol A和1.6mol B,壓強增大,平衡正向移動,故選;
故答案為:d.
點評 本題考查化學平衡的計算,為高頻考點,把握圖中物質的量濃度變化、平衡移動的影響因素為解答的關鍵,側重分析與應用能力的考查,注意圖象分析及相關計算,題目難度不大.


 優質課堂快樂成長系列答案
優質課堂快樂成長系列答案科目:高中化學 來源: 題型:選擇題
| A. | 純堿用于制造玻璃 | B. | 醫藥上用小蘇打治療胃酸過多 | ||
| C. | 打磨磁石制指南針 | D. | 工業上利用合成氨實現人工固氮 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將鐵粉加入FeCl3、CuCl2混合溶液中,充分反應后剩余的固體中必有鐵 | |
| B. | 濃硫酸和濃鹽酸長期露置在空氣中濃度均降低 | |
| C. | 將CO2氣體分別通入BaCl2溶液、Ba(NO3)2溶液中,最終都有沉淀生成 | |
| D. | 用加熱分解的方法可將NH4Cl固體和Ca(OH)2固體的混合物分離 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀硫酸滴在銀片上:2Ag+2H+=2Ag++H2↑ | |
| B. | 氧化鐵與稀鹽酸混合:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 碳酸鈣溶于醋酸溶液中:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 澄清石灰水與稀硝酸反應:Ca(OH)2+2H+=Ca2++2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同溫同壓下,反應H2(g)+Cl2(g)﹦2HCl(g) 在光照和點燃條件的△H相同 | |
| B. | 常溫下,反應 C(s)+CO2(g)﹦2CO(g)不能自發進行,則該反應的△H>0 | |
| C. | △H<0、△S>0的反應在任何條件下都能自發進行 | |
| D. | 反應N2(g)+3H2(g)?2NH3(g),加入催化劑能加快反應速率并提高轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
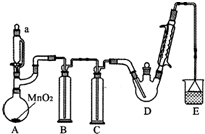 某探究小組設計如圖所示裝置(夾持、加熱儀器略),模擬工業生產進行制備三氯乙醛(CCl3CHO)的實驗.查閱資料,有關信息如下:
某探究小組設計如圖所示裝置(夾持、加熱儀器略),模擬工業生產進行制備三氯乙醛(CCl3CHO)的實驗.查閱資料,有關信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相對分子質量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔點/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸點/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 與水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 人類目前所直接利用的能量大部分是由化學反應產生的 | |
| B. | 人體運動所消耗的能量與化學反應無關 | |
| C. | 在多能源時期,氫能、生物質能等的核心仍然是化學反應 | |
| D. | 核能、太陽能的利用取決于新型材料的合成與開發 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能夠發生化學反應的碰撞是有效碰撞 | |
| B. | 增大濃度會加快化學反應速率,其原因是增加了單位體積內活化分子的數目 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-53.7kJ•mol-1,若將含0.5 molH2SO4的稀硫酸與含0.5molBa(OH)2的溶液混合,放出的熱量大于53.7kJ | |
| D. | 若化學平衡正向移動,則反應物的轉化率會增大,平衡常數也必發生變化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com