
|
向含有1 mol HCl和1 mol MgSO4的混合溶液中加入1 mol/L Ba(OH)2溶液.下列圖象能正確表示產生沉淀的物質的量(n)與加入溶液的體積(V)之間關系的是 | |
| [ ] | |
A. |
|
B. |
|
C. |
|
D. |
|
 補充習題江蘇系列答案
補充習題江蘇系列答案 學練快車道口算心算速算天天練系列答案
學練快車道口算心算速算天天練系列答案科目:高中化學 來源:遼寧省沈陽二中2010-2011學年高二下學期期末考試化學試題 題型:022
某溫度下,容積同為2 L的3個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如下
(已知某溫度下2HI(g)![]() H2(g)+I2(g);ΔH=+A kJ·mol-1;K=4.0)
H2(g)+I2(g);ΔH=+A kJ·mol-1;K=4.0)

(1)根據上表回答問題
①c1、c3的關系式為________
②a、b的關系式為________
③p2、p3的關系式為________
④α1與α2的關系式為________
(2)甲容器中:該反應的平衡常數表達式為________.
(3)乙容器中:反應在開始2分鐘后達平衡狀態,則該反應在這2分鐘的平均反應速率為________mol·L-1·min-1(用含有c2的代數式表示)
(4)丙容器中:反應開始時進行的方向是________(填“向左”、“向右”或“不動”)
(5)乙容器中:當反應達到平衡狀態后,向容器中再充入1 mol H2,則1分鐘后,正反應速率與原平衡時相比________(填“增大”、“不變”或“減小”)
查看答案和解析>>
科目:高中化學 來源:江蘇省上岡高級中學2011-2012學年高二下學期期中考試化學試題 題型:022
弱電解質的電離平衡、鹽類的水解平衡和難溶物的溶液平衡均屬于化學平衡.
Ⅰ、已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-.
H++A2-.
(1)NaHA溶液________(選填“顯酸性”、“顯堿性”、“顯中性”或“無法確定”).
(2)某溫度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性.此時該混合溶液中下列關系中,一定正確的是________.
a.c(H+)·c(OH-)=1×10―14
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)
d.c(Na+)+c(K+)=0.05 mol/L
(3)已知常溫下H2A的鈣鹽(CaA)飽和溶液中存在以下平衡:
CaA(s)①溫度降低時,K sp________(填“增大”、“減小”或“不變”,下同).
②滴加少量濃鹽酸,c(Ca2+)________.
Ⅱ、含有Cr2O72-的廢水毒性較大,某工廠廢水中含5.00×10-3 mol·L-1的Cr2O72-.為使廢水能達標排放,作如下處理:
Cr2O72-(4)欲使10 L該廢水中的Cr2O72-完全轉化為Cr3+,理論上需要加入________g FeSO4·7H2O.
(5)若處理后的廢水中殘留的c(Fe3+)=2×10-13 mol·L-1,則殘留的Cr3+的濃度為________.(已知:Ksp[Fe(OH)3]=4.0×10-38Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目:高中化學 來源:湖北省襄陽五中2012屆高三上學期期中考試化學試題 題型:022
氮及其化合物與人們的生活息息相關.
(1)實驗室可用銅與稀硝酸反應制取NO,其離子方程式是________.
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1根據①和②,標準狀況下的4.48 L CH4恰好將NO2轉化為N2時ΔH=________.
(3)同溫同壓下,3.5 L NH3恰好將3.0 L NO和NO2的混合氣完全轉化為N2,則原混合氣中NO和NO2的體積比是________.
(4)向含有1 mol HNO3的稀硝酸中逐漸加入鐵粉,所得氧化產物a、b與鐵粉物質的量關系如圖所示,則n3=________p=________.
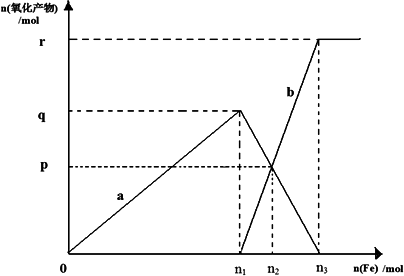
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題沖刺第7講 水溶液中的離子平衡練習卷(解析版) 題型:填空題
弱電解質的電離平衡、鹽類的水解平衡和難溶物的溶解平衡均屬于化學平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-??H++A2-。
(1)常溫下NaHA溶液的pH________(填序號),原因是_________________。
A.大于7 B.小于7
C.等于7? D.無法確定
(2)某溫度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的體積變化)。此時該混合溶液中的下列關系一定正確的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常溫下H2A的鈣鹽(CaA)的飽和溶液中存在以下平衡:CaA(s)??Ca2+(aq)+A2-(aq) ΔH>0。若要使該溶液中Ca2+濃度變小,可采取的措施有________。
A.升高溫度?????????????????? B.降低溫度
C.加入NH4Cl晶體??????????? D.加入Na2A固體
Ⅱ.含有Cr2O72-的廢水毒性較大,某工廠廢水中含5.0×10-3 mol·L-1的Cr2O72-。為了使廢水的排放達標,進行如下處理:
(1)該廢水中加入綠礬和H+,發生反應的離子方程式為____________________。
(2)若處理后的廢水中殘留的c(Fe3+)=2.0×10-13 mol·L-1,則殘留的Cr3+的濃度為________。
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com