
| A. | Na+K+ SO42- HCO3- | B. | Cu2+ K+ SO42- NO3- | ||
| C. | Na+ K+ Cl- NO3- | D. | Al3+ K+ SO42-OH- |
科目:高中化學 來源: 題型:解答題
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
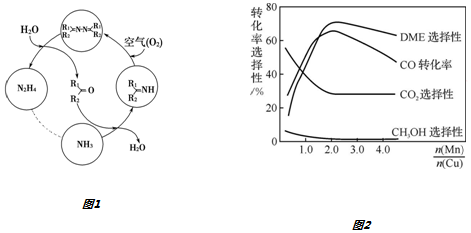
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 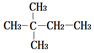 | B. | 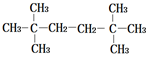 | ||
| C. | CH3CH2CH2CH2CH2CH3 | D. | CH3CH2CH2CH2CH2CH2CH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 密閉、低溫是存放氨水的必要條件 | |
| B. | 實驗室常用排飽和食鹽水法收集氯氣 | |
| C. | 打開汽水瓶時,有大量氣泡冒出 | |
| D. | 已知合成氨的反應為N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,工業上采用較高溫度和使用催化劑以提高氨氣的產率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用25mL堿式滴定管量取高錳酸鉀溶液,體積為16.60mL | |
| B. | 用標準NaOH溶液滴定未知濃度鹽酸,用去NaOH溶液20.50mL | |
| C. | 用10mL量筒量取8.25mL鹽酸 | |
| D. | 用普通pH試紙測得某溶液pH為3.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 化學鍵 | C-H | C-C | C═C | H-H |
| 鍵能/kJ•mol-1 | 412 | 348 | 612 | 436 |
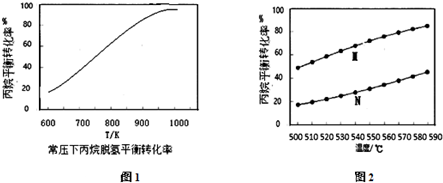
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com