
合成氨技術(shù)的創(chuàng)立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的平衡常數(shù)K值和溫度的關系如下:
| 溫 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①寫出工業(yè)合成氨的化學方程式。
 ②由上表數(shù)據(jù)可知該反應為放熱反應,理由是。
②由上表數(shù)據(jù)可知該反應為放熱反應,理由是。
③理論上,為了增大平衡時H2的轉(zhuǎn)化率,可采取的措施是。(填序號)
a.增大壓強 b.使用合適的催化劑
c.升高溫度 d.及時分離出產(chǎn)物中的NH3
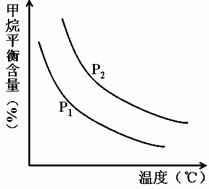
(2)原料氣H2可通過反應 CH4(g) + H2O (g)![]() CO(g) + 3H2(g) 獲取,已知該反應中,當初始混合氣中的
CO(g) + 3H2(g) 獲取,已知該反應中,當初始混合氣中的![]() 恒定時,溫度、壓強對平衡混合氣CH4含量的影響如下圖所示:
恒定時,溫度、壓強對平衡混合氣CH4含量的影響如下圖所示:
①圖中,兩條曲線表示壓強的關系是:P1P2(填“>”、“=”或“<”)。
②該反應為反應(填“吸熱”或“放熱”)。
(3)原料氣H2還可通過反應CO(g) + H2O(g) ![]() CO2 (g) + H2(g) 獲取。
CO2 (g) + H2(g) 獲取。
①T ℃時,向容積固定為5 L的容器中充入1 mol水蒸氣和1 mol CO,反應達平衡后,測得CO的濃度為0.08 mol·L-1,則平衡時CO的轉(zhuǎn)化率為,該溫度下反應的平衡常數(shù)K值為。
②保持溫度仍為T ℃,改變水蒸氣和CO的初始物質(zhì)的量之比,充入容器進行反應,下列描述能夠說明體系處于平衡狀態(tài)的是
(填序號)。
a.容器內(nèi)壓強不隨時間改變
b.混合氣體的密度不隨時間改變
c.單位時間內(nèi)生成a mol CO2的同時消耗a mol H2
d.混合氣中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6
科目:高中化學 來源:2015屆山東省濟寧市高二12月質(zhì)檢化學試卷(解析版) 題型:填空題
合成氨技術(shù)的創(chuàng)立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的平衡常數(shù)K值和溫度的關系如下:
|
溫 度(℃) |
360 |
440 |
520 |
|
K值 |
0.036 |
0.010 |
0.0038 |
(1)①寫出工業(yè)合成氨的化學方程式_________________________________________。
②由上表數(shù)據(jù)可知該反應為放熱反應,理由是_____________________________________。
③理論上,為了增大平衡時H2的轉(zhuǎn)化率,可采取的措施是。(填序號)
a.增大壓強 b.使用合適的催化劑
c.升高溫度 d.及時分離出產(chǎn)物中的NH3
(2)原料氣H2可通過反應 CH4(g)
+ H2O (g)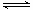 CO(g)
+ 3H2(g) 獲取,已知該反應中,當初始混合氣中的
CO(g)
+ 3H2(g) 獲取,已知該反應中,當初始混合氣中的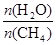 恒定時,溫度、壓強對平衡混合氣CH4含量的影響如下圖所示:
恒定時,溫度、壓強對平衡混合氣CH4含量的影響如下圖所示:
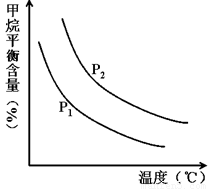
①圖中,兩條曲線表示壓強的關系是:P1________P2(填“>”、“=”或“<”)。
②該反應為_____________反應(填“吸熱”或“放熱”)。
(3)原料氣H2還可通過反應CO(g) +
H2O(g)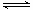 CO2
(g) + H2(g) 獲取。
CO2
(g) + H2(g) 獲取。
①T ℃時,向容積固定為5 L的容器中充入1 mol水蒸氣和1 mol CO,反應達平衡后,測得CO的濃度為0.08 mol·L-1,則平衡時CO的轉(zhuǎn)化率為______,該溫度下反應的平衡常數(shù)K值為_________。
②保持溫度仍為T ℃,改變水蒸氣和CO的初始物質(zhì)的量之比,充入容器進行反應,下列描述能夠說明體系處于平衡狀態(tài)的是_____________(填序號)。
a.容器內(nèi)壓強不隨時間改變
b.混合氣體的密度不隨時間改變
c.單位時間內(nèi)生成a mol CO2的同時消耗a mol H2
d.混合氣中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6
查看答案和解析>>
科目:高中化學 來源:2013-2014學年山東省新泰市高三上學期階段化學試卷(解析版) 題型:填空題
合成氨技術(shù)的創(chuàng)立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的平衡常數(shù)K值和溫度的關系如下:
|
溫 度(℃) |
360 |
440 |
520 |
|
K值 |
0.036 |
0.010 |
0.0038 |
(1)①由上表數(shù)據(jù)可知該反應為放熱反應,理由是 。
② 理論上,為了增大平衡時H2的轉(zhuǎn)化率,可采取的措施是 。(填序號)
a.增大壓強 b.使用合適的催化劑
c.升高溫度 d.及時分離出產(chǎn)物中的NH3
(2)原料氣H2可通過反應 CH4(g)
+ H2O (g) CO(g)
+ 3H2(g) 獲取,已知該反應中,當初始混合氣中的
CO(g)
+ 3H2(g) 獲取,已知該反應中,當初始混合氣中的 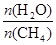 恒定時,溫度、壓強對平衡混合氣CH4含量的影響如下圖所示:
恒定時,溫度、壓強對平衡混合氣CH4含量的影響如下圖所示:
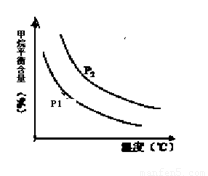
①圖中,兩條曲線表示壓強的關系是:P1 P2(填“>”、“=”或“<”)。
②該反應為 反應(填“吸熱”或“放熱”)。
(3)原料氣H2還可通過反應CO(g) +
H2O(g) CO2
(g) + H2(g) 獲取。
CO2
(g) + H2(g) 獲取。
①T ℃時,向容積固定為5 L的容器中充入1 mol水蒸氣和1 mol CO,反應達平衡后,測得CO的濃度為0.08 mol·L-1,則平衡時CO的轉(zhuǎn)化率為 ,該溫度下反應的平衡常數(shù)K值為 。
②保持溫度仍為T ℃,改變水蒸氣和CO的初始物質(zhì)的量之比,充入容器進行反應,下列描述能夠說明體系處于平衡狀態(tài)的是 (填序號)。
a.容器內(nèi)壓強不隨時間改變
b.混合氣體的密度不隨時間改變
c.單位時間內(nèi)生成a mol CO2的同時消耗a mol H2
d.混合氣中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6
查看答案和解析>>
科目:高中化學 來源:2014屆北京市海淀區(qū)高三上學期期中考試化學試卷(解析版) 題型:填空題
合成氨技術(shù)的創(chuàng)立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的平衡常數(shù)K值和溫度的關系如下:
|
溫 度(℃) |
360 |
440 |
520 |
|
K值 |
0.036 |
0.010 |
0.0038 |
(1)①寫出工業(yè)合成氨的化學方程式 。
②由上表數(shù)據(jù)可知該反應為放熱反應,理由是 。
③理論上,為了增大平衡時H2的轉(zhuǎn)化率,可采取的措施是 。(填序號)
a.增大壓強 b.使用合適的催化劑
c.升高溫度 d.及時分離出產(chǎn)物中的NH3
(2)原料氣H2可通過反應 CH4(g)+H2O
(g)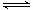 CO(g)+3H2(g)
獲取,已知該反應中,當初始混合氣
CO(g)+3H2(g)
獲取,已知該反應中,當初始混合氣
中的 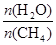 恒定時,溫度、壓強對平衡混合氣CH4含量的影響如下圖所示:
恒定時,溫度、壓強對平衡混合氣CH4含量的影響如下圖所示:
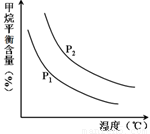
①圖中,兩條曲線表示壓強的關系是:P1 P2(填“>”、“=”或“<”)。
②該反應為 反應(填“吸熱”或“放熱”)。
(3)原料氣H2還可通過反應CO(g)+H2O(g)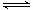 CO2
(g)+H2(g) 獲取。
CO2
(g)+H2(g) 獲取。
①T ℃時,向容積固定為5 L的容器中充入1 mol水蒸氣和1 mol CO,反應達平衡后,測得CO的濃度
為0.08 mol·L-1,則平衡時CO的轉(zhuǎn)化率為 ,該溫度下反應的平衡常數(shù)K值為 。
②保持溫度仍為T ℃,改變水蒸氣和CO的初始物質(zhì)的量之比,充入容器進行反應,下列描述能夠說
明體系處于平衡狀態(tài)的是 (填序號)。
a.容器內(nèi)壓強不隨時間改變
b.混合氣體的密度不隨時間改變
c.單位時間內(nèi)生成a mol CO2的同時消耗a mol H2
d.混合氣中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
合成氨技術(shù)的創(chuàng)立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的平衡常數(shù)K值和溫度的關系如下:
| 溫 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①寫出工業(yè)合成氨的化學方程式。
②由上表數(shù)據(jù)可知該反應為放熱反應,理由是。
③理論上,為了增大平衡時H2的轉(zhuǎn)化率,可采取的措施是。(填序號)
a.增大壓強 b.使用合適的催化劑
c.升高溫度 d.及時分離出產(chǎn)物中的NH3
 (2)原料氣H2可通過反應 CH4(g) + H2O (g)
(2)原料氣H2可通過反應 CH4(g) + H2O (g)![]() CO(g) + 3H2(g) 獲取,已知該反應中,當初始混合氣中的
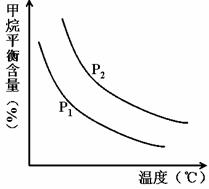
CO(g) + 3H2(g) 獲取,已知該反應中,當初始混合氣中的![]() 恒定時,溫度、壓強對平衡混合氣CH4含量的影響如下圖所示:
恒定時,溫度、壓強對平衡混合氣CH4含量的影響如下圖所示:
①圖中,兩條曲線表示壓強的關系是:P1P2(填“>”、“=”或“<”)。
②該反應為反應(填“吸熱”或“放熱”)。
(3)原料氣H2還可通過反應CO(g) + H2O(g) ![]() CO2 (g) + H2(g) 獲取。
CO2 (g) + H2(g) 獲取。
①T ℃時,向容積固定為5 L的容器中充入1 mol水蒸氣和1 mol CO,反應達平衡后,測得CO的濃度為0.08 mol·L-1,則平衡時CO的轉(zhuǎn)化率為,該溫度下反應的平衡常數(shù)K值為。
②保持溫度仍為T ℃,改變水蒸氣和CO的初始物質(zhì)的量之比,充入容器進行反應,下列描述能夠說明體系處于平衡狀態(tài)的是
(填序號)。
a.容器內(nèi)壓強不隨時間改變
b.混合氣體的密度不隨時間改變
c.單位時間內(nèi)生成a mol CO2的同時消耗a mol H2
d.混合氣中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com