
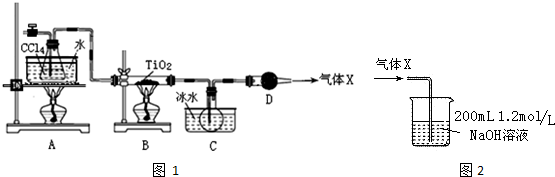
| 物質 | 熔點/℃ | 沸點/℃ | 其他 |
| CCl4 | -23 | 76.8 | 與TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮濕空氣產生白霧 |
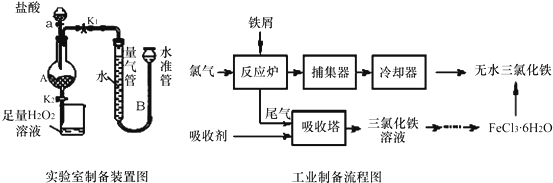
分析 為防止產品TiCl4被氧化,實驗開始時先點燃A處的酒精燈,使四氯化碳揮發,排盡系統(裝置)中的空氣,待C中燒瓶里有液滴出現時再點燃B處的酒精燈,B中裝置在加熱條件下,發生反應TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),CCl4、TiCl4熔點較低,C裝置使這兩種物質轉化為液態,二者能互溶,應該采用蒸餾方法分離,D裝置連接空氣,由于TiCl4遇潮濕空氣產生白霧,發生水解反應,故D裝置作用是防止空氣中水蒸進入,據此分析解答.
解答 解:(1)由TiCl4的熔沸點較低,則TiCl4為分子晶體,共價化合物,所以TiCl4中化學鍵的類型是共價鍵,故答案為:共價鍵;
(2)TiO2和 CCl4為在加熱條件下生成TiCl4和CO2;,則反應的方程式為:TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g);故答案為:TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g);
(3)根據以上分析,CCl4、TiCl4熔點較低,C裝置使這兩種物質轉化為液態,二者能互溶,所以最好剩余的X氣體主要是CO2,故答案為:CO2;
(4)為防止產品TiCl4被氧化,先排盡系統(裝置)中的空氣,所以實驗開始時先點燃A處的酒精燈,使四氯化碳揮發,排盡系統(裝置)中的空氣,待C中燒瓶里有液滴出現時再點燃B處的酒精燈,故答案為:排盡系統(裝置)中的空氣;
(5)CCl4、TiCl4二者能互溶,應該采用蒸餾方法分離,故答案為:蒸餾;
(6)根據反應TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),則8.0g TiO2和足量 CCl4為原料制取TiCl4,則生成CO2的物質的量為$\frac{8.0g}{80g/mol}$=0.1mol,向200ml1.2mol/L即0.2×1.2=0.24mol的NaOH溶液中通入0.1molCO2,發生反應:2NaOH+CO2═Na2CO3,氫氧化鈉過量,所以生成的鹽是Na2CO3,又由于二氧化碳在過程中有損失,則生成鹽的總物質的量n≤0.1mol;
故答案為:Na2CO3;0.1mol.
點評 本題考查實驗制備方案,明確原理是解題關鍵,側重考查學生裝置的分析評價,注意對題目信息的提取與應用,是對學生綜合能力的考查,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 由一種元素組成的物質一定是單質 | |
| B. | 凡是能電離出H+的化合物都是酸 | |
| C. | 堿能電離出OH-而使溶液顯堿性,但溶液顯堿性的不一定是堿 | |
| D. | 氨溶于水形成的溶液能導電,所以氨是電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在恒溫恒容的密閉容器中,通入lmolN2和3molH2,發生反應:N2(g)+3H2(g)$?_{催化劑}^{高溫高壓}$ 2NH3(g).
在恒溫恒容的密閉容器中,通入lmolN2和3molH2,發生反應:N2(g)+3H2(g)$?_{催化劑}^{高溫高壓}$ 2NH3(g).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
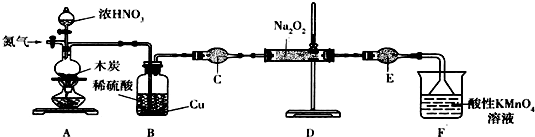
| 次數 | 2 | 3 | ||
| KMnO體積/m | 20.60 | 20.02 | 20.00 | 9.98 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 溫度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com