
【題目】銻(Sb)廣泛用于生產各種阻燃劑、陶瓷、半導體元件、醫藥及化工等領域。以輝銻礦為原料制備金屬銻,其一種工藝流程如下:

己知部分信息如下:
I.輝銻礦(主要成分為Sb2S3,還含有As2S5、PbS 、CuO和SiO2等);
II.浸出液主要含鹽酸和SbCl3,還含SbCl5、CuCl2、AsCl3和PbCl2等雜質;
III.常溫下,Ksp(CuS)=1.0×10-36 Ksp(PbS)=9.0×10-29
回答下列問題:
(1)“酸浸”過程中SbCl5和Sb2S3反應有S生成,該反應的還原產物是________(填化學式)。
(2)寫出“還原”反應的化學方程式:______________ 。
(3)已知:浸出液中:c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1。在沉淀銅、鉛過程中,緩慢滴加極稀的硫化鈉溶液,先產生的沉淀是_______(填化學式);當CuS、PbS共沉時,![]() =_________。加入硫化鈉的量不宜過多,原因是_________。
=_________。加入硫化鈉的量不宜過多,原因是_________。
(4)在“除砷”過程中,氧化產物為H3PO4。該反應中氧化劑、還原劑的物質的量之比___________。
(5)在“電解”過程中,以惰性材料為電極,陰極的電極反應式為______;“電解”中銻的產率與電壓大小關系如圖所示。當電壓超過U0V時,銻的產率降低的原因可能是______。

【答案】 SbCl3 3 SbCl5+ 2Sb=5SbCl3 CuS 9.0×107 避免砷、銻離子沉淀 4:3 Sb3++3e-=Sb H+參與了電極反應
【解析】分析:由工藝流程可知,輝銻礦粉經鹽酸、五氯化銻溶液浸取后,過濾,向濾液中加入適量的銻粉把過量的五氯化銻還原,然后再加入適量的硫化鈉把溶液中的銅離子和鉛離子沉淀,過濾,再向濾液中加入次磷酸鈉除砷,得到三氯化銻溶液,電解該溶液得到銻和五氯化銻,五氯化銻循環利用。
詳解:(1)“酸浸”過程中SbCl5和Sb2S3反應有S生成,該反應的氧化劑為SbCl5,其還原產物是SbCl3。
(2) “還原”反應的化學方程式為3SbCl5+ 2Sb=5SbCl3。
(3)浸出液中c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1。常溫下,Ksp(CuS)=1.0×10-36 Ksp(PbS)=9.0×10-29,CuS的溶度積較小,故在沉淀銅、鉛過程中,緩慢滴加極稀的硫化鈉溶液,先產生的沉淀是CuS;當CuS、PbS共沉時,![]() =
= ![]() 9.0×107。加入硫化鈉的量不宜過多,防止砷、銻離子轉化為沉淀。
9.0×107。加入硫化鈉的量不宜過多,防止砷、銻離子轉化為沉淀。
(4)在“除砷”過程中,次磷酸鈉是還原劑,其氧化產物為H3PO4,P的化合價由+1升高到+5、升高了4,而As的化合價由+3降到0、降低了3,故該反應中氧化劑、還原劑的物質的量之比4:3。
(5)在“電解”過程中,以惰性材料為電極,陰極發生還原反應,其電極反應式為Sb3++3e-=Sb;由“電解”中銻的產率與電壓大小關系示意圖可知,當電壓超過U0V時,銻的產率降低,其原因可能是H+參與了電極反應。


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:
【題目】下列反應過程中不能產生H2的是( )
A.金屬鈉和水反應
B.高溫條件,鐵和水蒸氣反應
C.加熱條件下,銅和足量濃硫酸發生反應
D.鋁和氫氧化鈉溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.生石灰與水混合的過程只發生物理變化
B.O3是由3個氧原子構成的化合物
C.CuSO4·5H2O是一種混合物
D.可用丁達爾效應區分溶液與膠體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于說法正確的是
A. HCl和NaOH反應的中和熱為57.3kJ/mol,H2SO4和Ba(OH)2反應的中和熱也為57.3kJ/mol
B. 已知C2H5OH(l)的燃燒熱是1366.8kUmol,則C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)反應的△H=-1366.8kJ/mol
C. 一定溫度和壓強下,將0.5molN2和1.5molH2置于密閉容器中充分反應生成NH3(g),放出熱量19.3kJ.則其熱化學方程式為N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ/mol
2NH3(g) △H=-38.6 kJ/mol
D. 一定條件下2SO2(g)+O2(g)![]() 2SO3(g)△H1 2SO2(g)+O2(g)
2SO3(g)△H1 2SO2(g)+O2(g)![]() 2SO3(l)△H2則△H1>△H2
2SO3(l)△H2則△H1>△H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知部分弱酸的電離平衡常數如下表:
弱酸 | HCOOH | HCN | H2CO3 |
電離平衡常數(25℃) | K=1.77×10-4 | K=5.0×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列敘述錯誤的是
A. NaCN溶液中通人少量CO2發生的離子反應為:CN-+H2O+CO2=HCN+HCO3-
B. 等體積、等物質的量濃度的HCOONa和NaCN溶液中所含陰離子總數前者大于后者
C. 等物質的量濃度的NaHCO3和Na2CO3混合溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
D. 中和等體積、等pH的HCOOH溶液和HCN溶液消耗NaOH的物質的量前者小于后者
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H、N、Na、Al、Ti等元素在能源、材料等領域應用廣泛。回答下列問題:
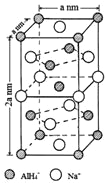
(一)氫化鋁鈉(NaAlH4)是一種新型輕質儲氫材料,摻入少量Ti的NaAlH4在150℃時釋氫,在170℃、15.2MPa條件下又重復吸氫。NaAlH4可由AlCl3和NaH在適當條件下合成。NaAlH4的晶胞結構如圖所示,為長方體。
(1)基態Ti原子的價電子排布圖為_________,L能層中電子云的形狀有_______種。
(2)AlCl3在178℃時升華,屬于__________晶體,其蒸氣的相對分子質量約為267,蒸氣分子的結構式為___________(標明配位鍵),其中Al的軌道雜化方式為____________。
(3)寫出與AlH4-空間構型相同的一種分子和一種離子_________(填化學式)。
(4)NaAlH4晶體中,與AlH4-緊鄰且等距的Na+有__________個;NaAlH4晶體的密度為_____________g·cm-3(用含a的代數式表示)。
(二)疊氮化鈉和氫疊氮酸(HN3)已一步步進入我們的生活,如汽車安全氣囊等。
(1)寫出與N3-屬于等電子體的一種分子__________(填分子式)。
(2)氫疊氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同時生成水。下列敘述錯誤的是___(填標號)
A.上述生成HN3的化學方程式為:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氫疊氮酸(HN3)和水能形成分子間氫鍵
D.HN3和N2H4都是由極性鍵和非極性鍵構成的非極性分子。
E.HN3分子中四個原子可能在一條直線上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚氨酯類高分子材料PU用途廣泛,其合成反應為:
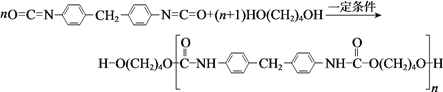
下列說法不正確的是
A. HO(CH2)4OH的沸點高于CH3CH2CH2CH3
B. 高分子材料PU在強酸、強堿中能穩定存在
C. 合成PU的兩種單體的核磁共振氫譜中均有3個吸收峰
D. 以1,3-丁二烯為原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國政府承諾,到2020年,單位GDP二氧化碳排放比2005年下降40%~45%。有效“減碳”的手段之一是節能。
I.下列制氫方法最節能的是______(填字母序號)。
A.電解水制氫:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B.高溫使水分解制氫:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.太陽光催化分解水制氫:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然氣制氫:CH4+H2O![]() CO+3H2
CO+3H2
II.科學家提出“綠色自由”構想,把空氣中的CO2使用合適的催化劑可轉化為可再生能源甲醇(CH3OH)。該反應的熱化學方程式為:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
(1)若在一個定溫定容的容器中發生上述反應,反應達到平衡的標志是______ (填字母序號)。
A.CO2和CH3OH的濃度相等 B.3v正(H2)=v逆(H2O)
C.容器內壓強保持不變 D.H2的百分含量保持不變
E. 容器中混合氣體的密度保持不變
(2)若將CO2和H2的混合氣體分成五等份,將它們分別充入溫度不同、容積相同的恒容容器中發生上述反應。反應相同時間后,測得甲醇的體積分數φ(CH3OH)與反應溫度T的關系如右圖,則上述CO2轉化為甲醇的反應的△H______0(填“>”、“<”或“=”)。

(3) 300℃時,將CO2和H2按1:3的體積比充入某密閉容器中,CO2的平衡轉化率(α)與體系總壓強(P)的關系如右圖所示。回答問題:

①若其他條件不變,將A點的體積壓縮至原來的一半,一段時間后反應再次達到平衡,與原平衡相比較下列說法正確的是_______(填字母序號)。
A.CO2的濃度減小 B.正反應速率增大,逆反應速率增大
C.甲醇的物質的量增加 D.重新平衡時n(H2)/n(CH3OH)增大
②B點平衡混合氣體的平均摩爾質量為________(保留一位小數)。
(4)甲醇—空氣燃料電池(DMFC)是一種高效能、輕污染電動汽車的車載電池,其工作原理示意圖如圖,該燃料電池的電池反應式為2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l),則負極的電極反應式為____________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氣是重要化工原料,在國民經濟中占重要地位。工業合成氨的反應為: N2(g)+H2(g)=2NH3(g) △H<0
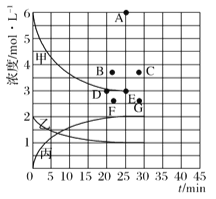
(1)右圖表示合成NH3反應在某段時間t0→t6中反應速率與反應過程的曲線圖,t1、t3、t4 時刻分別改變某一外界條件,則在下列到達化學平衡的時間段中,NH3的體積分數最小的一段時間是___________(填寫下列序號)

A.t1→t1 B.t2→t3 C.t3→t4 D.t5→t6
t4時改變的條件是________________。
進行如下研究:在773K時,分別將2molN2和6molH2充入一個固定容積為1L的密閉容器中,隨著反應的進行,氣體混合物中n(H2)、n(NH3)與反應時間t的關系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(2)該溫度下,此反應的平衡常數K=____________。
(3)該溫度下,若向同容積的另一容器中投入的N2、H2、NH3的濃度分別為3mo/L、3mol/L、3mo/L,則此時V正_____V逆 (填">"“<”或“=”)。
(4)由上表中的實驗數據計算得到“濃度一時間”的關系可用右圖中的曲線表示,表示c(N2)-t的曲線是______。在此溫度下,若起始充入4molN2和12 molH2,則反應剛達到平衡時,表示c(H2)-t的曲線上相應的點為_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com