
【題目】貯氫合金![]() 可催化由CO、
可催化由CO、![]() 合成
合成![]() 等有機化工產品的反應。溫度為TK時發生以下反應:
等有機化工產品的反應。溫度為TK時發生以下反應:
①![]()
![]()
②![]()
![]()
③![]()
④![]()
(1)溫度為TK時,催化由CO、![]() 合成
合成![]() 反應的熱化學方程式為________。
反應的熱化學方程式為________。
(2)已知溫度為TK時![]() 的活化能為
的活化能為![]() ,則其逆反應的活化能為________
,則其逆反應的活化能為________![]() 。
。
(3)![]() 時,向一恒壓密閉容器中充入等物質的量的
時,向一恒壓密閉容器中充入等物質的量的![]() 和
和![]() 發生上述反應②
發生上述反應②![]() 已排除其他反應干擾
已排除其他反應干擾![]() ,測得
,測得![]() 物質的量分數隨時間變化如下表所示:
物質的量分數隨時間變化如下表所示:
時間 | 0 | 2 | 5 | 6 | 9 | 10 |
|
|
|
|
|
|
|
若初始投入CO為![]() ,恒壓容器容積
,恒壓容器容積![]() ,用
,用![]() 表示該反應
表示該反應![]() 分鐘內的速率
分鐘內的速率![]() ________。6分鐘時,僅改變一種條件破壞了平衡,則改變的外界條件為________。
________。6分鐘時,僅改變一種條件破壞了平衡,則改變的外界條件為________。
(4)![]() 下,在恒容密閉容器中,充入一定量的甲醇,發生反應④,若起始壓強為
下,在恒容密閉容器中,充入一定量的甲醇,發生反應④,若起始壓強為![]() ,達到平衡轉化率為
,達到平衡轉化率為![]() ,則反應的平衡常數
,則反應的平衡常數![]() ________
________![]() 用平衡分壓代替平衡濃度計算,分壓
用平衡分壓代替平衡濃度計算,分壓![]() 總壓
總壓![]() 物質的量分數,忽略其它反應
物質的量分數,忽略其它反應![]() 。
。
(5)某溫度下,將![]() 與
與![]() 的混合氣體充入容積為
的混合氣體充入容積為![]() 的密閉容器中,在催化劑的作用下發生反應③。經過
的密閉容器中,在催化劑的作用下發生反應③。經過![]() 后,反應達到平衡,此時轉移電子
后,反應達到平衡,此時轉移電子![]() 。若保持體積不變,再充入
。若保持體積不變,再充入![]() 和
和![]() ,此時
,此時![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。下列不能說明該反應已達到平衡狀態的是________。
。下列不能說明該反應已達到平衡狀態的是________。
![]() 的質量不變
的質量不變 ![]() 混合氣體的平均相對分子質量不再改變
混合氣體的平均相對分子質量不再改變
![]()
![]() 混合氣體的密度不再發生改變
混合氣體的密度不再發生改變
(6)已知![]() 、
、![]() 時水煤氣變換中CO和
時水煤氣變換中CO和![]() 分壓隨時間變化關系如下圖所示,催化劑為氧化鐵。實驗初始時體系中的
分壓隨時間變化關系如下圖所示,催化劑為氧化鐵。實驗初始時體系中的![]() 和
和![]() 相等、
相等、![]() 和
和![]() 相等;已知
相等;已知![]() 時
時![]() 的
的![]() 。
。

![]() 時
時![]() 隨時間變化關系的曲線是________,
隨時間變化關系的曲線是________,![]() 時
時![]() 隨時間變化關系的曲線是________。
隨時間變化關系的曲線是________。
【答案】![]()
![]()
![]()
![]() 降低溫度
降低溫度 ![]()
![]() cd
cd ![]() d
d
【解析】
(1)![]()
![]()
![]()
![]() ,由蓋斯定律可知,
,由蓋斯定律可知,![]() 得到
得到![]() ,
,![]() ,則熱化學方程式為:
,則熱化學方程式為:![]() ;
;
(2)已知溫度為TK時![]() 的活化能為
的活化能為![]() ,根據
,根據![]() 正反應的活化能
正反應的活化能![]() 逆反應的活化能,則逆反應的活化能
逆反應的活化能,則逆反應的活化能![]() ;
;
(3)根據初始投入CO為![]() ,則
,則![]() 也為
也為![]() ,恒壓容器容積
,恒壓容器容積![]() ,
,
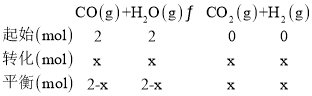
5min時![]() 物質的量分數為
物質的量分數為![]() ,
,![]() ,解得
,解得![]() ,用
,用![]() 表示該反應
表示該反應![]() 分鐘內的速率
分鐘內的速率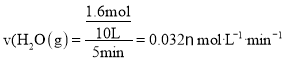 ;因為此平衡不受壓強影響,正反應是放熱反應,所以6分鐘時,僅改變一種條件破壞了平衡,根據表格數據
;因為此平衡不受壓強影響,正反應是放熱反應,所以6分鐘時,僅改變一種條件破壞了平衡,根據表格數據![]() 物質的量分數減小,平衡應正向移動,則改變的外界條件為降低溫度;
物質的量分數減小,平衡應正向移動,則改變的外界條件為降低溫度;
![]() 下,在恒容密閉容器中,充入一定量的甲醇,發生反應
下,在恒容密閉容器中,充入一定量的甲醇,發生反應![]() ,若起始壓強為101kPa,達到平衡轉化率為
,若起始壓強為101kPa,達到平衡轉化率為![]() ,設充入甲醇為amol,
,設充入甲醇為amol,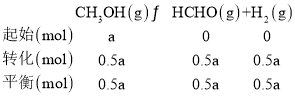
體積不變的密閉容器內,壓強之比等于物質的量之比,則![]() ,則
,則![]() ;則反應的平衡常數
;則反應的平衡常數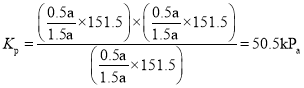 ;
;
(5)某溫度,將![]() 與
與![]() 的混合氣體充入容積為
的混合氣體充入容積為![]() 的密閉容器中,在催化劑的作用下發生反應:
的密閉容器中,在催化劑的作用下發生反應:![]() ,反應消耗1molCO,反應轉移4mol電子,經過
,反應消耗1molCO,反應轉移4mol電子,經過![]() 后,反應達到平衡,此時轉移電子
后,反應達到平衡,此時轉移電子![]() ,則反應消耗CO為
,則反應消耗CO為![]() ,
,

則平衡常數為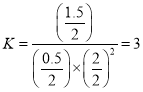 ,
,
若保持體積不變,再充入![]() 和
和![]() ,則濃度商為
,則濃度商為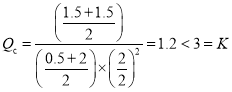 ,反應正向進行,所以此時v(正)>v(逆);
,反應正向進行,所以此時v(正)>v(逆);
a.![]() 的質量不變,能說明該反應已達到平衡狀態,故a不選;
的質量不變,能說明該反應已達到平衡狀態,故a不選;
b.反應前后氣體分子數不相等,隨反應進行混合氣體的平均相對分子質量發生變化,則混合氣體的平均相對分子質量不再改變,能說明該反應已達到平衡狀態,故b不選;
c.v正(CO)=2v正(H2),正逆反應速率不相等,不能說明該反應已達到平衡狀態,故c選;
d.反應物質總質量不變,容器體積不變,密度是一個定值,則混合氣體的密度不再發生改變,不能說明該反應已達到平衡狀態,故d選;
(6)對于放熱反應來說,溫度越低,平衡常數越大,所以![]() 時平衡常數大于
時平衡常數大于![]() 時平衡常數,在
時平衡常數,在![]() 和
和![]() 時,平衡常數大于
時,平衡常數大于![]() ,由此可知,最終平衡時生成物的分壓要大于反應物的分壓,因此,
,由此可知,最終平衡時生成物的分壓要大于反應物的分壓,因此,![]() 分壓一定比CO要大;再由曲線變化幅度可知,則曲線a、b為氫氣的分壓曲線,曲線c、d為一氧化碳的分壓曲線。因為此反應為放熱反應,所以溫度越低,氫氣的分壓就越高,一氧化碳的分壓就越低,所以a、b曲線中,曲線b為
分壓一定比CO要大;再由曲線變化幅度可知,則曲線a、b為氫氣的分壓曲線,曲線c、d為一氧化碳的分壓曲線。因為此反應為放熱反應,所以溫度越低,氫氣的分壓就越高,一氧化碳的分壓就越低,所以a、b曲線中,曲線b為![]() 時
時![]() 隨時間變化關系的曲線,曲線c、d中,曲線d為
隨時間變化關系的曲線,曲線c、d中,曲線d為![]() 時
時![]() 隨時間變化關系的曲線。
隨時間變化關系的曲線。


 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是( )
A.在稀AgNO3溶液中加入過量 NaCl溶液,產生白色沉淀,再加入少量 Na2S溶液,出現黑色沉淀,則加入Na2S溶液后 c(Ag+) 更小了
B.吸熱反應TiO2(s)+2Cl2(g) =TiCl4(g)+O2(g)一定條件下可自發進行,則該反應ΔS<0
C.實驗室制氫氣,為了加快反應速率,可向稀 H2SO4中滴加少量 Cu(NO3)2溶液
D.N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,僅升高溫度,達平衡時氫氣轉化率增大
2NH3(g) ΔH<0,僅升高溫度,達平衡時氫氣轉化率增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=Q1 kJ·mol-1;CO2(g)+NaOH(aq)=NaHCO3(aq) △H=Q2 kJ·mol-1。將15.68 L(標準狀況)CO2氣體通入1 L 1.0 mol·L-1氫氧化鈉溶液中,反應完全時能量變化為Q3 kJ則Q1、Q2、Q3之間的關系正確的是( )
A.Q3=0.3 Q1+0.4Q2B.Q3=0.7Q1C.Q3=0.7Q2D.Q3=0.4Q1+0.3Q2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25°C時,向10mL0.10mol·L-1的一元弱酸HA(Ka =1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH隨加入NaOH溶液體積的變化關系如圖所示。下列說法正確的是( )

A.a點時,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a點和b點時水的電離程度相同
C.b點時,c(Na+)=c(HA)+c(A- )+c(OH-)
D.V =10mL時,c(Na+)>c(A-)>c(H+)>c(HA)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:①2H2(g)+O2(g)===2H2O(l) ΔH=-570.0 kJ·mol-1;②CO(g)+![]() O2(g)===CO2(g) ΔH=-280 kJ·mol-1。某H2和CO的混合氣體完全燃燒放出141 kJ熱量,同時消耗標準狀況下5.6 L O2,則原混合氣體中H2和CO的物質的量之比為( )
O2(g)===CO2(g) ΔH=-280 kJ·mol-1。某H2和CO的混合氣體完全燃燒放出141 kJ熱量,同時消耗標準狀況下5.6 L O2,則原混合氣體中H2和CO的物質的量之比為( )
A.2∶1B.1∶2C.1∶1D.2∶3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用標準鹽酸溶液測定某NaOH溶液的濃度,用甲基橙作指示劑,下列操作中可能使測定結果偏低的是( )
A.酸式滴定管在裝酸液前未用標準鹽酸溶液潤洗2~3次
B.開始實驗時酸式滴定管尖嘴部分有氣泡,在滴定過程中氣泡消失
C.錐形瓶內溶液顏色變化由黃色變橙色,立即記下滴定管液面所在刻度
D.盛NaOH溶液的錐形瓶滴定前用NaOH溶液潤洗2~3次
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.乳酸薄荷醇酯( ![]() )僅能發生水解、氧化、消去反應
)僅能發生水解、氧化、消去反應
B.乙醛和丙烯醛(![]() )不是同系物,它們與氫氣充分反應后的產物也不是同系物
)不是同系物,它們與氫氣充分反應后的產物也不是同系物
C.麥芽糖和纖維二糖水解后都只得到葡萄糖
D.檢驗某溶液中是否含有甲醛:在盛有2 mL 10%CuSO4溶液的試管中滴加0.5mL10%NaOH溶液,混合均勻,滴入待檢液,加熱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)  是常用指示劑酚酞。寫出該化合物中含氧官能團的名稱:______和______;
是常用指示劑酚酞。寫出該化合物中含氧官能團的名稱:______和______;
(2)寫出3甲基1丁烯的結構簡式____________;寫出有機物 的名稱____________。
的名稱____________。
(3)  的一氯代物有____________種;二氯代物有____________種;
的一氯代物有____________種;二氯代物有____________種;
(4)有機物K用于合成高分子材料,K可由![]() 水解制得,寫出K在濃硫酸作用下生成的聚合物的結構簡式__________;
水解制得,寫出K在濃硫酸作用下生成的聚合物的結構簡式__________;
(5) 的一種同分異構體具有以下性質:①難溶于水,能溶于NaOH溶液;②能發生銀鏡反應;③核磁共振氫譜有三組峰,且峰面積之比為1∶1∶1。寫出該物質與足量氫氧化鈉反應的化學方程式___________________________。
的一種同分異構體具有以下性質:①難溶于水,能溶于NaOH溶液;②能發生銀鏡反應;③核磁共振氫譜有三組峰,且峰面積之比為1∶1∶1。寫出該物質與足量氫氧化鈉反應的化學方程式___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
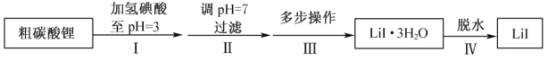
【題目】碘化鋰(![]() )在能源、醫藥等領域有重要應用,某興趣小組制備
)在能源、醫藥等領域有重要應用,某興趣小組制備![]() 和
和![]() ,流程如下:
,流程如下:
已知:![]() 在75~80℃轉變成
在75~80℃轉變成![]() ,80~120℃轉變成
,80~120℃轉變成![]() ,300℃以上轉變成無水
,300℃以上轉變成無水![]() 。
。
b.![]() 易溶于水,溶解度隨溫度升高而增大。
易溶于水,溶解度隨溫度升高而增大。
c.![]() 在空氣中受熱易被氧化。
在空氣中受熱易被氧化。
請回答:
(1)步驟II,調![]() ,為避免引入新的雜質,適宜加入的試劑為________。
,為避免引入新的雜質,適宜加入的試劑為________。
(2)步驟III,包括蒸發濃縮、冷卻結晶、過濾、洗滌、干燥等多步操作。
下列說法正確的是________。
A.為得到較大的![]() 晶體顆粒,宜用冰水浴快速冷卻結晶
晶體顆粒,宜用冰水浴快速冷卻結晶
B.為加快過濾速度,得到較干燥的晶體,可進行抽濾
C.宜用熱水洗滌
D.可在80℃鼓風干燥
(3)步驟IV,脫水方案為:將所得![]() 置入坩堝中,300℃加熱,得
置入坩堝中,300℃加熱,得![]() 樣品。用沉淀滴定法分別測定所得
樣品。用沉淀滴定法分別測定所得![]() 、
、![]() 樣品純度,測定過程如下:稱取一定量樣品,溶解,定容于容量瓶,將容量瓶中的溶液倒入燒杯,用移液管定量移取燒杯中的溶液加入錐形瓶,調
樣品純度,測定過程如下:稱取一定量樣品,溶解,定容于容量瓶,將容量瓶中的溶液倒入燒杯,用移液管定量移取燒杯中的溶液加入錐形瓶,調![]() ,用滴定管中的
,用滴定管中的![]() 標準溶液滴定至終點,根據消耗的
標準溶液滴定至終點,根據消耗的![]() 標準溶液體積計算,得
標準溶液體積計算,得![]() 、
、![]() 的純度分別為99.96%,95.38%。
的純度分別為99.96%,95.38%。![]() 純度偏低。
純度偏低。
①上述測定過程提及的下列儀器,在使用前一定不能潤洗的是________。
A.容量瓶 B.燒杯 C.錐形瓶 D.滴定管
②測定過程中使用到移液管,選出其正確操作并按序列出字母:
蒸餾水洗滌→待轉移溶液潤洗→________→_______→_______→_______→洗凈,放回管架。
a.移液管尖與錐形瓶內壁接觸,邊吹氣邊放液
b.放液完畢,停留數秒,取出移液管
c.移液管尖與錐形瓶內壁接觸,松開食指放液設備
d.洗耳球吸溶液至移液管標線以上,食指堵住管口
e.放液完畢,抖動數下,取出移液管
f.放液至凹液面最低處與移液管標線相切,按緊管口
③![]() 純度偏低,可能的主要雜質是________。
純度偏低,可能的主要雜質是________。

(4)步驟IV,采用改進的實驗方案(裝置如圖),可以提高![]() 純度。
純度。
①設備X的名稱是________。
②請說明采用該方案可以提高![]() 純度的理由________。
純度的理由________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com