
分析 A、B、C三種元素的原子具有相同的電子層數,1molA的單質能跟足量的鹽酸反應,在標準狀況下可置換出11.2L的H2,即0.5mol,A為金屬,設A反應后化合價為x,則根據電子轉移守恒,1x=0.5×2,所以x=1,即A反應后為+1價,這時A轉變為與氖原子具有相同電子層結構的離子,則A為Na元素.而B的核電荷數比A大2,則B為Al元素;C原子的電子總數比B原子的電子總數多4,則C為Cl元素,結合元素單質、化合物的性質解答該題.
解答 解:A、B、C三種元素的原子具有相同的電子層數,1molA的單質能跟足量的鹽酸反應,在標準狀況下可置換出11.2L的H2,即0.5mol,A為金屬,設A反應后化合價為x,則根據電子轉移守恒,1x=0.5×2,解得:x=1,即A反應后為+1價,這時A轉變為與氖原子具有相同電子層結構的離子,則A為Na元素.而B的核電荷數比A大2,則B為Al元素;C原子的電子總數比B原子的電子總數多4,則C為Cl元素,
(1)由以上分析可知A為Na,B為Al,C為Cl,
故答案為:Na;Al;Cl;
(2)A、B的最高價氧化物對應的水化物分別NaOH和Al(OH)3,C的氣態氫化物為HCl,
分別發生中和反應,反應的離子方程式分別為:H++OH-=H2O、Al(OH)3+3H+=Al3++3H2O,
故答案為:H++OH-=H2O;Al(OH)3+3H+=Al3++3H2O;
(3)Na的金屬性比Al強,單質的還原性Na比Al強,單質的還原性越強,對應的陽離子的氧化性越弱,
故答案為:弱;
(4)元素D的離子也與A、B的離子具有相同的電子層結構,其單質在反應中能作還原劑,則D為金屬,只能為Mg元素,
證明鎂元素的金屬性比鋁元素強,可利用金屬與酸的反應,最高價氧化物水化物的堿性來比較,
則方案一為:用形狀大小相同的鋁條和鎂條分別一等體積等濃度的稀鹽酸反應,觀察其反應速率快慢;
方案二為:分別向等體積等濃度的氯化鋁溶液、氯化鎂溶液中加入氫氧化鈉溶液至過量,觀察其沉淀及其溶解情況,
故答案為:用形狀大小相同的鋁條和鎂條分別一等體積等濃度的稀鹽酸反應,觀察其反應速率快慢;分別向等體積等濃度的氯化鋁溶液、氯化鎂溶液中加入氫氧化鈉溶液至過量,觀察其沉淀及其溶解情況.
點評 本題考查結構性質與位置關系,題目難度中等,涉及離子方程式等化學用語、化學計算等知識,根據計算推斷A元素是解題關鍵,是對所學知識的綜合考查,注意熟練掌握原子結構與元素周期律、元素周期表的關系.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
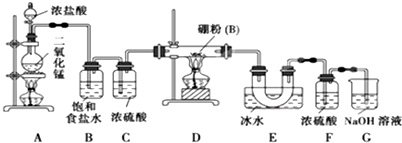
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl- 和NO3-一定來自不同的工廠 | B. | SO42- 和NO3-可能來自同一工廠 | ||
| C. | Ag+ 和Na+ 可能來自同一工廠 | D. | Na+ 和NO3-一定來自同一工廠 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用托盤天平稱取15.80g NaCl固體 | |
| B. | 用10mL量筒量取6.25 mL稀硝酸 | |
| C. | 用精密pH試紙測得某溶液的pH為4.2 | |
| D. | 做中和滴定實驗時,用50mL規格的酸式滴定管去取17.90mL的燒堿溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
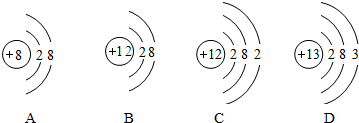
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 規律 | 結論 |
| A | 較強酸可以制取較弱酸 | H2S溶液無法制取H2SO4 |
| B | 反應物濃度越大,反應速率越快 | 常溫下,相同的鋁片中分別加入足量的濃、稀硝酸中,鐵絲在濃硫酸中先反應完 |
| C | 離子反應總是向著某種離子濃度減小的方向進行 | 反應2Na+2CH3COOH═2Na++2CH3COO-+H2↑不能進行 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀轉化 | MgCO3沉淀在水中煮沸,最終轉化為Mg(OH)2沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
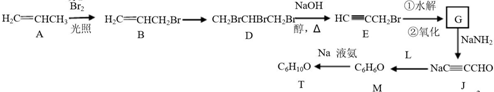
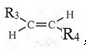 ,則T的結構簡式為
,則T的結構簡式為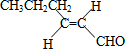 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com