
【題目】氯酸鈉是一種基礎化工原料。
(1)已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(l) ΔH=-186 kJ·mol-1,3ClO-(aq)=ClO3— (aq)+2Cl-(aq) ΔH=-113 kJ·mol-1,則:3Cl2(g)+6OH-(aq)=ClO3—(aq)+5Cl-(aq)+3H2O(l)ΔH=____kJ·mol-1,該反應中生成1molClO3—,轉移電子數為____。
(2)工業上采用無隔膜電解飽和食鹽水可制備氯酸鈉。該工藝過程中,生成氯酸鈉的相關反應為:Cl2+H2O![]() H++Cl-+HClO,HClO
H++Cl-+HClO,HClO![]() H++ClO-,2HClO+ClO-=ClO
H++ClO-,2HClO+ClO-=ClO![]() +2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物種分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與pH的關系如下圖。
+2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物種分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與pH的關系如下圖。
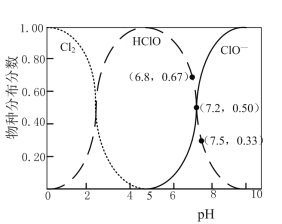
①電解過程中,為按化學計量數比反應,需控制電解液的pH約為___(填序號)。
A.5 B.6.8 C.7.2D.7.5
②若電解液堿度過大,陽極會有較多的O2放出,電極反應方程式為____。已知:Cr2O72—+H2O![]() 2CrO42—+2H+,電解時向食鹽水中加入的重鉻酸鈉(Na2Cr2O7)可以防止電解液堿度過大,其原理是____。
2CrO42—+2H+,電解時向食鹽水中加入的重鉻酸鈉(Na2Cr2O7)可以防止電解液堿度過大,其原理是____。
③若電解液pH<5時,溶液中HClO濃度會隨pH減小迅速降低,其原因是____(用離子方程式表示)。
(3)電解時須對電解槽進行冷卻處理以防止電解液溫度過高的原因是____。
(4)氯酸鈉與硫酸酸化的雙氧水溶液反應常用于制備飲用水消毒劑ClO2(g),該反應的化學方程式為____。
【答案】-671 5NA B 4OH--4e-=O2↑+2H2O 當堿度過大時,平衡Cr2O72—+H2O![]() 2CrO42—+2H+向右移動,抑制堿度增大 HClO+H++Cl-=Cl2↑+H2O 溫度過高,HClO分解速率加快,也不利于氯氣的溶解 2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
2CrO42—+2H+向右移動,抑制堿度增大 HClO+H++Cl-=Cl2↑+H2O 溫度過高,HClO分解速率加快,也不利于氯氣的溶解 2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
【解析】
根據蓋斯定律求出第三個方程式的焓變,根據化合價升降得出轉移電子數目;
根據生成的氯酸根的方程式中次氯酸和次氯酸根的比例得出pH值,
利用重鉻酸根的平衡移動原理分析怎樣防止氫氧根過量,
酸性過大,次氯酸會很快減少,主要是它們要發生反應生成氯氣,
溫度過高,會導致次氯酸分解。
氯酸鈉是一種基礎化工原料。
⑴已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(l) ΔH=-186 kJ·mol-1,
3ClO-(aq)=ClO3- (aq)+2Cl-(aq) ΔH=-113 kJ·mol-1,
將第一個方程乘以3再加上第二個方程得到
3Cl2(g)+6OH-(aq)=ClO3-(aq)+5Cl-(aq)+3H2O(l) ΔH=-671 kJ·mol-1,根據反應方程式知6個氯原子,其中1個氯原子升高5價,另外5個氯原子降低,每個氯原子降低1價,因此該反應中生成1molClO3-,轉移電子數為5NA,
故答案為:-671;5NA;
⑵①電解過程中,為按化學計量數比反應,即2HClO+ClO-=ClO![]() +2H++2Cl-反應,次氯酸根和次氯酸的比為1:2,則次氯酸占67%,因此根據圖中信息應該控制電解液的pH約為6.8,
+2H++2Cl-反應,次氯酸根和次氯酸的比為1:2,則次氯酸占67%,因此根據圖中信息應該控制電解液的pH約為6.8,
故答案為:B;
②若電解液堿度過大,陽極會有較多的O2放出,電極反應方程式為4OH--4e-= O2↑+2H2O,已知:電解時向食鹽水中加入的重鉻酸鈉(Na2Cr2O7),當氫氧根過大時,會消耗平衡Cr2O72-+H2O![]() 2CrO42-+2H+中的氫離子,致使平衡正向移動,有效降低了氫氧根過大,
2CrO42-+2H+中的氫離子,致使平衡正向移動,有效降低了氫氧根過大,
故答案為:4OH--4e-= O2↑+2H2O;當堿度過大時,平衡Cr2O72-+H2O![]() 2CrO42-+2H+向右移動,抑制堿度增大
2CrO42-+2H+向右移動,抑制堿度增大
③若電解液pH<5時,溶液中HClO濃度會隨pH減小迅速降低,其原因是次氯酸和氯離子、氫離子三者反應生成氯氣和水,其離子方程式為HClO+H++Cl-=Cl2↑+H2O,
故答案為:HClO+H++Cl-=Cl2↑+H2O;
⑶電解時須對電解槽進行冷卻處理以防止電解液溫度過高,次氯酸在溫度較高條件下要分解,而且溫度高不利于氯氣的溶解,因此溫度不能過高的原因是溫度過高,HClO分解速率加快,也不利于氯氣的溶解,
故答案為:溫度過高,HClO分解速率加快,也不利于氯氣的溶解;
⑷氯酸鈉與硫酸酸化的雙氧水溶液反應常用于制備飲用水消毒劑ClO2(g),氯酸鈉中氯的化合價降低生成消毒劑,雙氧水中氧的化合價升高變為氧氣,因此該反應的化學方程式為2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O,
故答案為:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O。


科目:高中化學 來源: 題型:
【題目】在含鎳酸性廢水中用電解法可以實現鐵上鍍鎳并得到氯化鈉,其裝置如圖所示,下列敘述正確的是

A.待鍍鐵棒為陽極
B.選用鎳棒替換碳棒,鍍鎳效果更好
C.陽極的電極反應式為4OH- — 4e-=O2↑+2H2O
D.通電后中間隔室的NaCl溶液濃度減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年10月9日,瑞典皇家科學院將諾貝爾化學獎授予古迪納夫等三位科學家,表彰他們在鋰離子電池方面的研究成果,鈷酸鋰電池是他們的研究成果之一,其工作原理為LixC6+Li1-xCoO2![]() C6+LiCoO2。下列說法正確的是
C6+LiCoO2。下列說法正確的是
A.放電時Li+從正極通過導線流向負極
B.放電時負極的電極反應式為:LixC6-xe-=C6+xLi+
C.充電時電池的負極與電源的正極相連
D.充電時陰極的電極反應式為:LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理知識研究如何利用CO、SO2等污染物有重要意義。
(1)用CO可以合成甲醇。
已知:①CO的燃燒熱△H1=-283kJmol-1
②N2(g)+O2(g)2NO(g) △H2=+183kJmol-1
則寫出CO和NO反應生成無污染氣體的熱化學反應方程式________ 。
(2)一定壓強下,在容積為2L的密閉容器中充入1molCO與2molH2,在催化劑作用下發生反應:CO(g)+2H2(g)CH3OH(g) △H ,CO轉化率與溫度和壓強的關系如下圖所示。
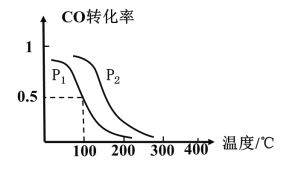
①反應的△H____ 0 ,p1___ p2(填>、< 或=)
②100℃時,反應進行了10秒達到平衡狀態,用CO表示該反應的化學反應速率是______ ,該反應的化學平衡常數K=____ 。
③下列說法正確的是______。
A.若容器內氣體密度恒定,反應達到平衡狀態 B.若容器內各氣體濃度恒定,反應達到平衡狀態
C.上述反應中,△H>0 D.反應中,催化劑使平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,表中所列的字母分別代表一種元素。
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
試回答下列問題(注意:每問中的字母代號為上表中的字母代號,并非為元素符號)
(1)N的單質和水蒸氣反應能生成固體X,則I的單質與X反應的化學方程式_______。
(2)D的氣態氫化物的VSEPR模型的名稱為_______。
(3)由A、C、D形成的ACD分子中,σ鍵和π鍵個數比= _______________。
(4)要證明太陽上是否含有R 元素,可采用的方法是__________________________。
(5)元素M的化合物(ME2L2)在有機合成中可作氧化劑或氯化劑,能與許多有機物反應。回答問題:
①ME2L2常溫下為深紅色液體,能與CCl4、CS2等互溶,據此可判斷ME2L2是_________(填“極性”或“非極性”)分子。
②將N和O的單質用導線連接后插入D的最高價氧化物對應的水化物濃溶液中,可制成原電池,則組成負極材料的元素的外圍電子軌道表示式為______________________。
(6)往O2+溶液中加入氨水,形成藍色沉淀,繼續加入氨水,難溶物溶解變成藍色透明溶液,寫出沉淀溶解的離子方程式_____。
(7)若F 、K兩種元素形成的化合物中中心原子的價電子全部參與成鍵,則該化合物的空間構型的名稱為___。
(8)如圖四條折線分別表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素氣態氫化物沸點變化,則E的氫化物所在的折線是__(填m、n、x或y)。

(9)1183 K以下純N晶體的基本結構單元如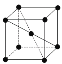 所示,1183 K以上轉變為
所示,1183 K以上轉變為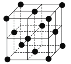 所示結構的基本結構單元。在1183 K以下的晶體中,空間利用率為____;在1183 K以上的晶體中,與N原子等距離且最近的N原子數為____,晶體堆積方式的名稱為_____。
所示結構的基本結構單元。在1183 K以下的晶體中,空間利用率為____;在1183 K以上的晶體中,與N原子等距離且最近的N原子數為____,晶體堆積方式的名稱為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化氯(ClO2)是極易溶于水且不與水發生化學反應的黃綠色氣體,沸點為11℃,可用于處理部分含硫廢水。某小組在實驗室中利用下列裝置制備ClO2(此制備方法中經空氣稀釋的SO2與ClO2不反應)。
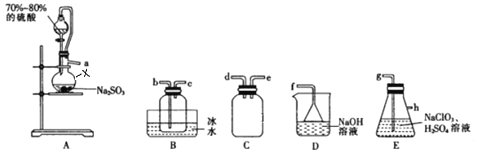
回答下列問題:
(1)儀器X的名稱是__________________________。
(2)欲選擇上圖中的裝置收集ClO2,其連接順序為a→______(按氣流方向,用小寫字母表示)。
(3)裝置C的作用是_________,裝置E中反應的離子方程式為__________________________________。
(4)處理含硫(Na2S)堿性廢水時,ClO2與Na2S反應(S2-被氧化為SO42-)的離子方程式為_________________;處理含硫堿性廢水時,相同條件下同體積的ClO2相對于Cl2的優點是______________________________。
(5)ClO2很不穩定,需現用現配,為測定所得溶液中ClO2的含量,進行下列實驗:
步驟1:準確量取V1 mL ClO2溶液加入錐形瓶中。
步驟2:用稀硫酸調節ClO2溶液的pH≤2.0,再加入足量KI晶體,靜置片刻。
步驟3:加入指示劑,用c mol·L-1的Na2S2O3標準溶液滴定至終點時,消耗V2 mL Na2S2O3標準溶液。
(已知:2ClO2+8H++10I-===2C1-+5I2+4H2O;2S2O32-+I2===2I-+S4O62-)原溶液中ClO2的含量為____________(用含c、V1、V2的代數式表示)g·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.用系統命名法命名有機物![]() 和
和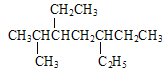 主鏈碳原子數均為7個
主鏈碳原子數均為7個
B.某烴的分子式為C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子結構中只有一個烷基,符合條件的烴有4種
C.碳原子數小于或等于8的單烯烴中,與HBr加成產物只有一種結構,符合條件的單烯烴有6種
D.苯甲醛分子中所有的原子不一定共平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活密切相關,下列有關說法中正確的是![]()
A.氮的化合物過渡排放,會導致光化學煙霧、酸雨、水華的產生
B.常溫下用鐵制容器儲存干燥的![]() 、常溫下濃硝酸可用鋁制容器存放運輸、加熱條件下濃硫酸能與木炭反應,其實質相似
、常溫下濃硝酸可用鋁制容器存放運輸、加熱條件下濃硫酸能與木炭反應,其實質相似
C.K、Ca、Na、Mg、Al只能用電解法制取,Fe、Cu只能用熱還原法制取
D.向蛋白質溶液中加入![]() 溶液、
溶液、![]() 溶液,均有沉淀生成,其原理相同
溶液,均有沉淀生成,其原理相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com