
【題目】上海某一超市銷售的某種食用精制鹽包裝袋上有如下說明:

(1)碘酸鉀與碘化鉀在酸性條件下發生如下反應,配平化學方程式并畫出電子轉移的方向與數目:_____KIO3+_____KI+_____H2SO4=_____K2SO4+_____I2+_____H2O;電子轉移情況如下(雙線橋表示)__________________________________;
(2)上述反應生成的I2可用叫氯化碳萃取,并用分液漏斗分離出兩種溶液。其實驗操作可分解為如下幾步:
A.把盛有溶液的分液漏斗放在鐵架臺的鐵圈中;
B.把50mL碘水和15mL CCL4加入分液漏斗中,并蓋好玻璃塞;
C.檢驗分液漏斗活塞上的玻璃塞是否漏液;
D.倒轉漏斗用力振蕩,并不時旋開活塞放氣,最后關閉活塞,把分液漏斗方正;
E.旋開活塞,用燒杯接收溶液;
F.從分液漏斗的上口倒出上層水溶液;
G.靜置,分層。
a、正確的操作順序是(用編號字母填寫)_____→_____→_____→A→_____→_____E→F。
b、下列物質。還能用作從溶液中萃取碘的溶劑是_____。
A.苯 B.碘化鉀 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,將I2還原,以回收四氯化碳。Na2SO3稀溶液與I2反應的主要產物(化學式)是_____。
(4)已知:I2+2Na2S2O3=2NaI+Na2S4O6.某學生測定食用精制鹽的碘含量,其步驟為:
a.準確稱取wg食鹽,加適量蒸餾水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入過量KI溶液,使KIO3與KI反應完全;
c.以淀粉溶液為指示劑,逐滴加入物質的量濃度為2.0×10-3mol/L的Na2S2O3溶液15.00mL,恰好反應完全。
①判斷c中反應恰好完全依據的現象是_____。
②根據以上實驗和包裝袋說明,所測精制鹽的碘含量是(以含w的代數式表示)_____mg/kg。
【答案】1 5 3 3 3 3  C B D G H A Na2SO4、HI 溶液由藍色恰好變為無色
C B D G H A Na2SO4、HI 溶液由藍色恰好變為無色 ![]()
【解析】
(1)反應中KIO3與KI之間發生氧化還原反應生成I2,根據氧化劑、還原劑之間得失電子數目相等可知KIO3~5KI,結合原子守恒配平化學方程式;其中KIO3為氧化劑,I元素的化合價由+5價降低為0,I元素的化合價由-1價升高為0,化合價升高值=化合價降低值=轉移電子數=5,據此分析電子轉移情況;
(2)a、CCl4從碘水中萃取碘并用分液漏斗分離兩種溶液,操作為查漏→裝液→振蕩→靜置→分液,據此分析正確的操作步驟;
b、碘易溶于有機溶劑,且有機溶劑不溶于水,與水不反應,據此進行分析;
(3)亞硫酸根子與碘單質發生氧化還原反應生成硫酸鈉、碘化氫,據此寫出離子方程式;
(4)①由于碘遇淀粉顯藍色,據此性質進行滴定終點的判斷;
②根據(1)中的反應式可知,KIO3~3I2~6Na2S2O3,所以碘酸鉀的物質的量是2.0×10-5mol×1/6,根據m=![]() 計算出精制鹽的碘含量,注意單位變換。
計算出精制鹽的碘含量,注意單位變換。
(1)反應中KIO3與KI之間發生氧化還原反應生成I2,根據氧化劑、還原劑之間得失電子數目相等可知KIO3~5KI,結合原子守恒配平書寫可得化學方程式為:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O,其中KIO3為氧化劑,I元素的化合價由+5價降低為0,I元素的化合價由﹣1價升高為0,化合價升高值=化合價降低值=轉移電子數=5,電子轉移情況如下: ;
;
故答案為:1、5、3、3、3、3; ;
;
(2)a、CCl4從碘水中萃取碘并用分液漏斗分離兩種溶液,操作為查漏→裝液→振蕩→靜置→分液,則步驟為C→B→D→A→G→H→E→F;
故答案為:C;B;D;G;H;
b、選用苯從碘水中萃取碘,苯與水不互溶,而且碘在苯中的溶解度比在水中的大得多,碘化鉀溶液和酒精和水溶液混溶不能分層,故選A,
(3)亞硫酸根子與碘單質發生氧化還原反應生成硫酸鈉、碘化氫,離子方程式:Na2SO3+I2+H2O=Na2SO4+2HI,Na2SO3稀溶液與I2反應的主要產物是Na2SO4、HI;
(4)①由于碘遇淀粉顯藍色,所以判斷c中反應恰好完全時依據的現象是溶液由藍色恰好變為無色;
②根據(1)中的反應式可知,KIO3~3I2~6Na2S2O3,所以碘酸鉀的物質的量是2.0×10-5mol×![]() ,因此所測精制鹽的碘含量是
,因此所測精制鹽的碘含量是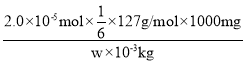 =
=![]() mg/kg。
mg/kg。


科目:高中化學 來源: 題型:
【題目】在盛有足量A的體積可變的密閉容器中,加入B,發生反應:A(s)+2B(g)![]() 4C(g)+D(g)ΔH<0。在一定溫度、壓強下達到平衡。平衡時C的物質的量與加入的B的物質的量的變化關系如圖。下列說法正確的是
4C(g)+D(g)ΔH<0。在一定溫度、壓強下達到平衡。平衡時C的物質的量與加入的B的物質的量的變化關系如圖。下列說法正確的是

A. 當溫度升高后,則圖中θ>45°
B. 若再加入B,再次達到平衡狀態時,正、逆反應速率均增大
C. 平衡時B的轉化率為50%
D. 若再加入B,則平衡后反應體系氣體密度減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示![]() 、
、![]() 裝置電解氯化銅溶液和飽和食鹽水。下列判斷錯誤的是( )
裝置電解氯化銅溶液和飽和食鹽水。下列判斷錯誤的是( )

A. 陽極失電子的離子相同、產物相同
B. 陰極產物因得電子的離子不同而不同
C. 電解后兩裝置中溶液的pH都減小
D. 電解后只有![]() 裝置陰極的質量增加
裝置陰極的質量增加
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨基鋰(LiNH2)是一種白色有光澤的結晶或粉末,熔點是390℃,沸點是430℃,溶于冷水,遇熱水則強烈水解。在380~400℃時鋰與氨氣直接反應可制得LiNH2,下面是實驗室制備LiNH2時可能用到的裝置圖,回答下列問題。

(1)僅從試劑性質角度分析,下列各組試劑不宜用于實驗室制備NH3的是___________(填宇母)。
A.濃氨水、CaO B.NH4Cl固體、Ca(OH)2固體
C.濃氨水 D.NH4NO3固體、NaOH固體
(2)用(1)中合適的試劑制取的NH3按氣流方向自左向右,則圖中裝置的連接順序為___________(填接口處宇母),裝置A的作用是______________________。
(3)裝置C中儀器的名稱是___________,盛裝的試劑是___________。實驗開始后,向X中通入NH3與加熱儀器X的先后順序為___________。
(4)實驗室還可用濃氨水與固體NaOH混合制備氨氣,但多次實驗表明,此方法收集到的NH3量總是比理論值低許多,其最可能的原因是______________________。
(5)氨基鋰能與熱水反應生成LiOH與一種氣體,請推測該氣體的成分并用實驗驗證你的結論:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】①5.2g的氣態乙炔(C2H2)在氧氣中燃燒,生成二氧化碳和液態水,放出260kJ的熱量,其熱化學方程式為:___________________________________________________________。又知H2O(l)==H2O(g)△H= +44kJ/mol,則11.2L(標準狀況)乙炔完全燃燒生成氣態水時放出的熱量是_________kJ。
②已知:CH4 的燃燒熱為890 kJ/mol,H2的熱值為142.5kJg-1,現有標準狀況下22.4 L CH4和H2的混合氣體完全燃燒時,放出的熱量為527kJ,求混合氣體中CH4 和H2的體積比_____________
③將1mol NO2投入到1L容器中進行 2NO2(g)![]() N2O4(g)反應,達到平衡后將體積壓縮到原來的一半再次達到平衡,則第一次平衡體系的顏色比第二次平衡的顏色_____________
N2O4(g)反應,達到平衡后將體積壓縮到原來的一半再次達到平衡,則第一次平衡體系的顏色比第二次平衡的顏色_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】熱激活電池可用作火箭、導弾的工作電源。一種熱激活電池的基本結鉤如圖所示,其中作為電解質的無水LiCl-KCl混合物受熱熔融后,電池即可瞬間輸出電能,此時硫酸鉛電極處生成Pb,下列有關說法正確的是( )

A. 輸出電能時,外電路中的電子由硫酸鉛電極流向鈣電極
B. 放電時電解質LiCl-KCl中的Li+向鈣電極區遷移
C. 每轉0.2mol電子,論上消耗42.5gLiCl
D. 電池總反應為Ca+PbSO4+2LiCl=Pb+Li2SO4+CaCl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,A是由X和Y兩種短周期元素組成的氣體,X的原子序數小于Y,甲、乙、丙分別是X、Y、Z元素對應的單質,Z是地殼中含量最高的元素,它們有如右圖所示的轉化關系。下列說法不正確的是

A. X、Y、Z三種元素能組成離子化合物
B. 反應②為化合反應,反應③為置換反應
C. 常溫常壓下,Z的簡單氫化物的熔沸點為同族最高
D. 原子半徑:Y>Z>X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列有關說法正確的是
A.46g N2O4氣體中含有的原子數為3NA
B.標準狀況下,22.4L SO3中含有SO3分子數為NA
C.50mL 12mol·L-1鹽酸與足量MnO2共熱,轉移的電子數為0.3NA
D.用電解法精煉銅的反應中轉移0.2NA個電子時,陽極溶解6.4g銅
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵氮化合物(FexNy)在磁記錄材料領域有著廣泛的應用前景。請回答下列問題:
(1)鐵元素基態原子的電子排布式為_________,3d能級上的未成對電子數為_________,能量最高能級的電子云形狀為_________。
(2)Fe3+可用KSCN溶液檢驗,形成的配合物顏色為_________,寫出一個與SCN-具有相同空間構型的分子:_________。
(3)氮元素的最簡單氫化物為氨,氨的沸點_________(填“高于”或“低于”)膦(PH3),原因是_________。氮元素另一種氫化物聯氨(N2H4)是_________(填“極性”或“非極性”)分子,其中心原子的軌道雜化類型為_________。
(4)鐵的第三電離能(I3),第四電離能(I4)分別為2957kJ/mol,5290kJ/mol,I4遠大于I3的原因是_________。
(5)鐵和氨氣在640℃可發生置換反應,產物之一的晶胞結構如圖所示,寫出該反應的化學方程式:_________。若兩個最近的Fe原子間的距離為a cm,則該晶體的密度是_________g/cm3(設阿伏加德羅常數的值為NA)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com