
分析 根據質量守恒可知2n(Mg2+)+3n(Al3+)=n(Cl-)=0.2L×1.3mol/L=0.26mol,因n(Mg2+)=0.2mol/L×0.2L=0.04mol,可知n(Al3+)=0.06mol,欲使Mg2+全部沉淀分離出來,可發生Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,結合離子方程式計算.
解答 解:溶液中含有鎂離子的物質的量為:n(Mg2+)=0.2mol/L×0.2L=0.04mol,
根據電荷守恒可知:2n(Mg2+)+3n(Al3+)=n(Cl-)=0.2L×1.3mol/L=0.26mol,
則鋁離子的物質的量為:n(Al3+)=$\frac{1}{3}$(0.26mol-0.04×2)=0.06mol,
欲使Mg2+全部沉淀分離出來,可發生Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,
則需要強氧化鈉的物質的量為:n(NaOH)=0.04mol×2+0.06mol×4=0.32mol,
需要消耗4molL的強氧化鈉溶液的體積為:V(NaOH)=$\frac{0.32mol}{4mol/L}$=0.08L=80mL,
答:要使Mg2+轉化為Mg(OH)2并使Mg2+、Al3+分離開來,至少需4mol/L的NaOH溶液80mL
點評 本題考查混合物反應的計算、離子方程式的計算,為高考常見題型,題目難度中等,試題側重于學生的分析能力和計算能力的考查,根據守恒計算鋁離子的物質的量為解答該題的關鍵.


 金牌課堂練系列答案
金牌課堂練系列答案 三新快車金牌周周練系列答案
三新快車金牌周周練系列答案科目:高中化學 來源: 題型:選擇題
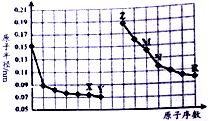
| A. | Y、R兩種元素的氣態氫化物穩定性大小:Y<R | |
| B. | 簡單離子的半徑:X>Z>M | |
| C. | 由X于N兩種元素組成的化合物不能與任何酸反應,但能與強堿反應 | |
| D. | Z單質能從M與R元素構成的鹽溶液中置換出單質M |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 該反應的化學方程式是CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 上述反應的正反應是放熱反應 | |
| C. | 增加CO,CO的平衡轉化率增大 | |
| D. | 若平衡濃度符合關系$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,則此時的溫度為1000℃ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH溶液可保存在玻璃塞的試劑瓶中 | |
| B. | 液溴應盛放在用水密封且用玻璃塞塞緊的棕色試劑瓶中 | |
| C. | 一學生用廣泛pH試紙測得某濃度的稀鹽酸pH為2.3 | |
| D. | 配制硫酸亞鐵溶液,是將綠礬晶體溶于蒸餾水再加入一定量的鐵粉 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | V(N2)=0.2mol•L-1•min-1 | B. | V(H2)=0.1mol•L-1•min-1 | ||
| C. | V(NH3)=0.4mol•L-1•min-1 | D. | V(H2)=0.3mol•L-1•min-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在熔融電解質中,O2-由正極移向負極 | |
| B. | 電解一共生成0.9 mol氣體時,理論上消耗0.1 mol丁烷 | |
| C. | 電解池的陽極反應式為4OH--4e-═2H2O+O2↑ | |
| D. | 通入空氣的一極是正極,電極反應式為O2+4e-═2O2- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ,該反應的反應類型是加成反應.
,該反應的反應類型是加成反應.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲烷分子的比例模型 | B. | 氨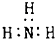 | ||
| C. | Cl-離子的結構示意圖 | D. | 8個中子的碳原子的符號${\;}_{6}^{14}$C |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
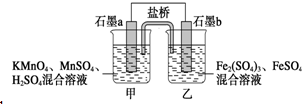 某小組將反應2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O設計為如圖原電池,其中甲、乙兩燒杯中各物質的物質的量濃度均為2mol•L-1,溶液的體積均為200mL,鹽橋中裝有飽和K2SO4溶液.下列說法中錯誤的是( )
某小組將反應2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O設計為如圖原電池,其中甲、乙兩燒杯中各物質的物質的量濃度均為2mol•L-1,溶液的體積均為200mL,鹽橋中裝有飽和K2SO4溶液.下列說法中錯誤的是( )| A. | 電池工作時,鹽橋中的SO42-移向乙燒杯 | |
| B. | 石墨b的電極反應式為Fe2+-e-═Fe3+ | |
| C. | 當有0.1 mol SO42-進入燒杯時,反應消耗H+0.2 mol | |
| D. | 當 MnSO4濃度變為2.2 mol•L-1時,反應中轉移電子0.2 mol(不考慮溶液的體積變化) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com