
 O2(g)=H2O(l) ΔH3=-285.8kJ?mol-1
O2(g)=H2O(l) ΔH3=-285.8kJ?mol-1 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2012-2013學年浙江寧波萬里國際學校高一下學期期中考試化學試卷(帶解析) 題型:填空題
為了合理利用化學能,確保安全生產,化工設計需要充分考慮化學反應的焓變,并采取相應的措施。化學反應的焓變一般通過實驗進行測定,也可進行理論推算。
(1)實驗測得,0.3mol氣態高能燃料乙硼烷(B2H6)在氧氣中燃燒,生成固態三氧化二硼和液態水,放出649.5kJ熱量。寫出上述燃燒反應的熱化學方程式 。標準狀況下11.2L乙硼烷完全燃燒生成液態水時放出的熱量是 kJ。
(2)在化學反應過程中,拆開化學鍵需要吸收能量,形成化學鍵又會釋放能量。已知拆開1mol氫氣中的化學鍵需要消耗436kJ能量,拆開1mol氧氣中的化學鍵需要消耗496kJ能量,形成水蒸氣中的1mol H-O鍵能夠釋放463kJ能量。試說明反應2H2(g)+O2(g)=2H2O(g)中的能量變化。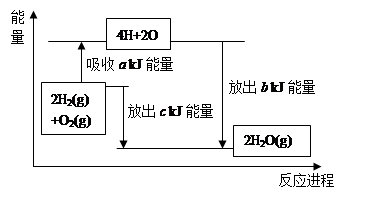
a= ,b= 。又知1mol液態水轉化成氣態水吸收44 kJ能量,則氫氣完全燃燒生成液態水時的熱化學方程式為 。
(3)依據蓋斯定律可以對某些難以通過實驗直接測定的化學反應的焓變進行推算。實驗中不能直接測出由石墨和氫氣生成甲烷反應的反應熱,但可測出CH4、石墨和H2燃燒熱分別如下:
①CH4(g)+2O2(g)=CO2(g)+2H2O ΔH1=-890.3 kJ?mol-1
②C(石墨)+O2(g)= CO2(g) ΔH2= —393.5 kJ?mol-1
③H2(g)+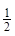 O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1
O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1
④C(石墨)+2H2(g)= CH4(g) ΔH4
試根據蓋斯定律求出石墨生成甲烷的反應熱ΔH4= 。
查看答案和解析>>
科目:高中化學 來源:2015屆浙江寧波萬里國際學校高一下學期期中考試化學試卷(解析版) 題型:填空題
為了合理利用化學能,確保安全生產,化工設計需要充分考慮化學反應的焓變,并采取相應的措施。化學反應的焓變一般通過實驗進行測定,也可進行理論推算。
(1)實驗測得,0.3mol氣態高能燃料乙硼烷(B2H6)在氧氣中燃燒,生成固態三氧化二硼和液態水,放出649.5kJ熱量。寫出上述燃燒反應的熱化學方程式 。標準狀況下11.2L乙硼烷完全燃燒生成液態水時放出的熱量是 kJ。
(2)在化學反應過程中,拆開化學鍵需要吸收能量,形成化學鍵又會釋放能量。已知拆開1mol氫氣中的化學鍵需要消耗436kJ能量,拆開1mol氧氣中的化學鍵需要消耗496kJ能量,形成水蒸氣中的1mol H-O鍵能夠釋放463kJ能量。試說明反應2H2(g)+O2(g)=2H2O(g)中的能量變化。

a= ,b= 。又知1mol液態水轉化成氣態水吸收44 kJ能量,則氫氣完全燃燒生成液態水時的熱化學方程式為 。
(3)依據蓋斯定律可以對某些難以通過實驗直接測定的化學反應的焓變進行推算。實驗中不能直接測出由石墨和氫氣生成甲烷反應的反應熱,但可測出CH4、石墨和H2燃燒熱分別如下:
①CH4(g)+2O2(g)=CO2(g)+2H2O ΔH1=-890.3 kJ?mol-1
②C(石墨)+O2(g)= CO2(g) ΔH2= —393.5 kJ?mol-1
③H2(g)+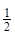 O2(g)=H2O(l)
ΔH3= ─285.8 kJ?mol-1
O2(g)=H2O(l)
ΔH3= ─285.8 kJ?mol-1
④C(石墨)+2H2(g)= CH4(g) ΔH4
試根據蓋斯定律求出石墨生成甲烷的反應熱ΔH4= 。
查看答案和解析>>
科目:高中化學 來源:2012年人教版高中化學選修4 1.1化學反應與能量的變化練習卷(解析版) 題型:計算題
實驗中不能直接測出由石墨和氫氣生成甲烷反應的反應熱,但可測出CH4、石墨和H2的燃燒熱。試求出石墨生成甲烷的反應熱。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.5kJ·mol-1;
C(石墨)+O2(g)= CO2(g) △H2=-393.5kJ·mol-1 ;
H2(g)+1/2O2(g)= H2O(l) △H3=-285.8kJ·mol-1。
求:C(石墨)+ 2H2(g)= CH4(g)△H4
查看答案和解析>>
科目:高中化學 來源:2012屆北京市高二下期3月份月考化學試卷 題型:填空題
根據要求寫出下列反應的熱化學方程式
(1)一定量氫氣與氯氣反應生成氯化氫氣體,當生成1mol氫氯鍵時放出91.5kJ的熱量________________________________________________________.
(2)某化學反應的能量變化如圖所示,該反應的熱化學方程式是(反應熱用abc表示)
_____________________________________________.
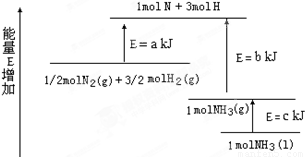
(3)某反應的平衡常數 如果有1molN2 完全反應,要吸收熱量68kJ.寫出該反應的熱化學方程式______________________________________________.
如果有1molN2 完全反應,要吸收熱量68kJ.寫出該反應的熱化學方程式______________________________________________.
(4)實驗中不能直接測出石墨和氫氣生成甲烷反應的反應熱,但可測出甲烷、石墨、氫氣燃燒的反應熱:
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol
C(石墨,s)+O2(g)=CO2(g) ;ΔH2=-393.5 kJ/mol
H2(g)+1/2O2(g)=H2O(l) ;△H3=-285.8 kJ/moL
則由石墨與氫氣反應生成甲烷的熱化學反應方程式為__________________________________________.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com