
【題目】鉻、硼的合金及其化合物用途非常廣泛。回答下列問題:
(1)基態Cr原子核外電子的排布式是[Ar] ___;基態硼原子中占據最高能級的電子云輪廓圖為____形。
(2)鉻的配合物有氯化三乙二胺合鉻![]() 和三草酸合鉻酸銨{(NH4)3[Cr(C2O4)3]}等。
和三草酸合鉻酸銨{(NH4)3[Cr(C2O4)3]}等。
①配體en表示NH2CH2CH2NH2,其中碳原子的雜化方式是____。
②NH4+空間構型為____,與其鍵合方式相同且空間構型也相同的含硼陰離子是_____ 。
③C、N、O三種元素第一電離能由小到大的順序為 ___;![]() 含有三個五元環,畫出其結構:_______________。
含有三個五元環,畫出其結構:_______________。
(3)硼酸[H3BO3或B(OH)3]為白色片狀晶體,熔點為171℃。下列說法正確的是___填字母)。
A.硼酸分子中,∠OBO的鍵角為120° B.硼酸分子中存在σ鍵和π鍵
C.硼酸晶體中,片層內存在氫鍵 D.硼酸晶體中,片層間存在共價鍵
(4)2019年11月《EurekAlert》報道了鉻基氮化物超導體,其晶胞結構如圖所示:

由三種元素Pr(鐠)、Cr、N構成的該化合物的化學式為 ___。
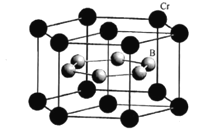
(5)CrB2的晶胞結構如圖所示,六棱柱底邊邊長為acm,高為c cm,阿伏加德羅常數的值為NA,CrB2的密度為 ___gcm-3(列出計算式)。
【答案】3d54s1 啞鈴(紡錘) sp3 正四面體 BH4- C<O<N 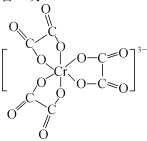 ABC Pr3Cr10N11
ABC Pr3Cr10N11 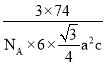 (或
(或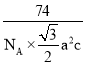 )
)
【解析】
(1)Cr為24號元素,基態Cr原子核外電子的排布式1s22s22p63s23p63d54s1,可表示為[Ar] 3d54s1;基態硼原子核外電子的排布式1s22s22p1,占據最高能級為2p,電子云輪廓圖為啞鈴(紡錘)型;
(2)①配體en表示NH2CH2CH2NH2,其中碳原子都是以單鍵連接,類似于甲烷中的碳原子鍵連方式,為sp3雜化;
②NH4+的中心原子為N,價層電子對數=4+![]() ×(5-1-1×4)=4,為sp3雜化,空間構型為正四面體型;互為等電子體的微粒,鍵合方式和空間構型相同,與NH4+互為等電子體的含硼陰離子為BH4-;
×(5-1-1×4)=4,為sp3雜化,空間構型為正四面體型;互為等電子體的微粒,鍵合方式和空間構型相同,與NH4+互為等電子體的含硼陰離子為BH4-;
③同周期元素從左到右電離能逐漸增大,處于全滿、半滿、全空狀態處于穩定狀態,比相鄰元素電離能大;N原子最外層電子為半充滿穩定狀態,C、N、O三種元素第一電離能由小到大的順序為C<O<N;![]() 含有三個五元環,Cr3+為配體,與C2O42-形成六個鍵,其結構為:
含有三個五元環,Cr3+為配體,與C2O42-形成六個鍵,其結構為: ;
;
(3)A.硼酸分子中心原子為B,B是sp2雜化,B和3個O共面形成平面三角形,則∠OBO的鍵角為120°,故A正確;
B.硼酸分子中每個硼原子最外層連有三個共價鍵,硼原子本身含有電子,故分子中硼原子最外層為6電子結構,形成離域π鍵,O原子與H原子以共價單鍵相連即含有σ鍵,故B正確;
C.硼酸是一種片層狀結構白色晶體,層內的H3BO3分子通過氫鍵相連,故C正確;
D.硼酸晶體熔沸點較低,屬于分子晶體,片層間是分子間作用力,故D錯誤;
答案選ABC;
(4)Pr6N9位于晶胞的棱上和體心,個數為12×![]() +1=4個,Cr8N13位于晶胞的頂點和面心,個數為8×
+1=4個,Cr8N13位于晶胞的頂點和面心,個數為8×![]() +6×
+6×![]() =4個,Cr6位于晶胞的體心,個數為8個,則一個晶胞中含有24個Pr、88個N和80個Cr,則分子式為Pr3Cr10N11;
=4個,Cr6位于晶胞的體心,個數為8個,則一個晶胞中含有24個Pr、88個N和80個Cr,則分子式為Pr3Cr10N11;
(5)Cr位于晶胞的頂點和上下面的面心,個數為12×![]() +2×
+2×![]() =3,B原子位于晶胞的體心,個數為6個,即一個晶胞中含有3個CrB2,底面積是6×
=3,B原子位于晶胞的體心,個數為6個,即一個晶胞中含有3個CrB2,底面積是6×![]() a2,高為c,則六棱柱的體積V=6×
a2,高為c,則六棱柱的體積V=6×![]() a2c,根據ρ=
a2c,根據ρ=![]() =
=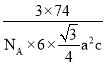 。
。


 輕松課堂單元期中期末專題沖刺100分系列答案
輕松課堂單元期中期末專題沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】下列說法錯誤的是( )
A.12g石墨中含有σ鍵的物質的量為1.5mol
B.硫離子電子共有18種運動狀態,且其2p與3p軌道形狀和能量相等
C.電負性:C<N<O
D.I3+離子的幾何構型是V型
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】到目前為止,由化學能轉變的熱能或電能仍然是人類使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃燒生成CO2和液態水時放出352kJ的熱量,則表示甲醇燃燒熱的熱化學方程式為______。
(2)化學反應中放出的熱能(焓變,△H)與反應物和生成物的鍵能(E)有關。已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,E(H﹣Cl)=432kJ/mol,E(Cl﹣Cl)=243kJ/mol則E(H﹣H)=_____。
(3)納米級Cu2O由于具有優良的催化性能而受到關注.已知:2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,則工業上用炭粉在高溫條件下還原CuO制取Cu2O和CO的熱化學方程式_____。
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,則工業上用炭粉在高溫條件下還原CuO制取Cu2O和CO的熱化學方程式_____。
(4)如圖是N2(g)和H2(g)反應生成2molNH3(g)過程中能量變化示意圖:
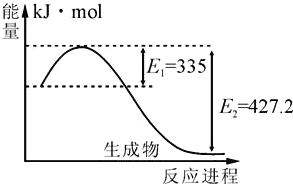
①請計算每生成1molNH3放出熱量為:______。
②若起始時向容器內充入1molN2和3molH2達平衡后N2的轉化率為20%,則反應放出的熱量為Q1kJ,則Q1的數值為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨甲環酸(G),別名止血環酸,是一種已被廣泛使用半個世紀的止血藥,它的一種合成路線如下(部分反應條件和試劑略)。
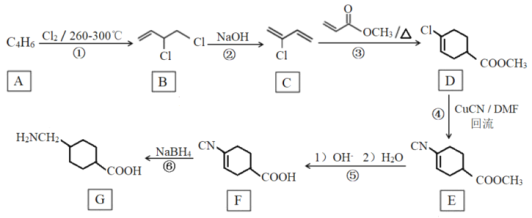
(1)A的名稱是_________________。
(2)②的化學方程式是___________。
(3)③的反應類型是_____________。
(4)D中的官能團名稱是_________。
(5)下列說法正確的是_____________(填字母序號)。
a.反應⑥是還原反應
b.F與![]() 互為同分異構體
互為同分異構體
c.G在堿性條件下可以轉變成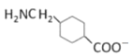
d.G在酸性條件下可以轉變成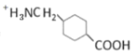
(6)寫出滿足以下條件的所有E的同分異構體的結構簡式______________________。
a. 與硝基苯互為同系物 b.苯環上只有兩個取代基 c.苯環上一氯代物有2種
(7)以CH3CH=CH2、HCHO為有機原料,選用必要的無機試劑合成上述流程中的A:CH3-CH=CH2![]() Br-CH2-CH=CH2→___________。已知:RX
Br-CH2-CH=CH2→___________。已知:RX![]() R—MgX
R—MgX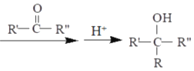 (R、R'、R〃代表烴基或氫)
(R、R'、R〃代表烴基或氫)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某礦石的主要成分為BaCO3(含Ca2+、Mg2+、Fe3+等雜質),實驗室利用該礦石制備BaCl22H2O的流程如圖,且三次濾渣的主要成分各不相同:
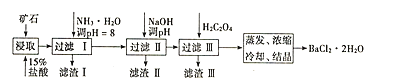
如表為常溫時各離子轉化為氫氧化物沉淀時的pH:
Fe3+ | Mg2+ | Ca2+ | |
開始沉淀時的pH | 1.9 | 9.1 | 11.9 |
完全沉淀時的pH | 3.2 | 11.1 | 13.9 |
(1)用15%鹽酸浸取前需充分研磨,目的是______。
(2)濾渣Ⅰ的主要成分為______;加入NaOH調pH的范圍為______;加入H2C2O4時應避免過量的原因是______。[已知難溶物質:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)已知:25℃時,Ksp(BaCO3)=5.4×10-9,Ksp(CaCO3)=2.7×10-9。向CaCO3固體的溶液中加入高濃度的BaCl2溶液,有BaCO3沉淀生成,請寫出該反應的離子方程式______,該反應的平衡常數K=______。
(4)取制得的BaCl22H2O(含少量雜質)2.5g配成100mL溶液,取10.00mL該溶液于燒杯中,加入足量(NH4)2C2O4溶液,過濾,洗滌,將得到的BaC2O4沉淀用過量稀硫酸溶液溶解,過濾除去BaSO4沉淀,將所得的H2C2O4溶液移入錐形瓶,用0.05mol/L高錳酸鉀標準液滴定至終點。
已知:Ba2++C2O42-═BaC2O4↓
BaC2O4+2H++SO42-═BaSO4↓+H2C2O4
5H2C2O4+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
①滴定中盛放高錳酸鉀標準液的儀器為______,滴入最后一滴高錳酸鉀溶液,錐形瓶中溶液顏色______,即說明達到滴定終點。
②若滴定前滴定管的讀數為1.80mL,滴定終點時滴定管中液面如圖,請計算BaCl22H2O的純度為______(保留3位有效數字)。
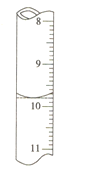
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用0.10molL-1的氨水滴定10.00mL0.05molL-1的二元酸H2A的溶液,滴定過程中加入氨水的體積(V)與溶液中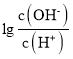 的關系如圖所示。下列說法正確的是( )
的關系如圖所示。下列說法正確的是( )

A.H2A的電離方程式為H2AH++HA-
B.B點溶液中,水電離出的氫離子濃度為1.0×10-6molL-1
C.C點溶液中,c(NH4+)+c(NH3H2O)=2c(A2-)
D.25℃時,氨水的電離平衡常數為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1980年,古迪的夫發明了鈷酸鋰材料,這種材料的結構可以使鋰離子在其中快速移動。以LiCoO2作電極材料的鋰離子電池在充、放電時的微觀粒子變化如圖所示,下列說法正確的是
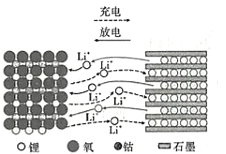
A.LiCoO2是電池的負極材料
B.充電時,LiCoO2電板的電勢低于石墨電極
C.充電時,陽極發生的反應是LiCoO2+xe-=Li1-xCoO2+xLi+
D.放電時,當1mol電子轉移,則石墨電極質量減少7g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】端炔烴在催化劑的存在下可發生偶聯反應,稱為Glaser反應。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
該反應在研究新型發光材料、超分子化學等方面具有重要價值。下面是利用Glaser反應由苯A制備化合物E的一種合成路線:


回答下列問題:
(1)B的結構簡式為________,D的化學名稱為________。
(2)①和③的反應類型分別為________、________。
(3)E的結構簡式為____________________。1 mol E與氫氣反應,理論上最多消耗氫氣________ mol。
(4)芳香化合物F是C的同分異構體,其分子中只有兩種不同化學環境的氫,數目比為3∶1,則符合條件的同分異構體有______種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知常溫下H2A的K1=1.0×10-4,K2=5.0×10-7。向20mLlmol·L-1的H2A溶液中逐滴滴入2mol·L-1的NaOH溶液,溶液中水電離出的c水(OH-)隨加入NaOH溶液的體積V的變化如圖所示,下列分析正確的是( )
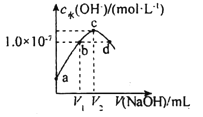
A.V1<10,V2=20
B.a點溶液的pH=3
C.c點溶液c水(H+)≈1.0×10-4mol·L-1
D.b、d點溶液均呈中性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com