
【題目】研究不同 pH 時 CuSO4 溶液對 H2O2 分解的催化作用。資料:a.Cu2O 為紅色固體,難溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 為棕褐色固體,難溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2 ![]() H+ +HO2-,HO2-
H+ +HO2-,HO2- ![]() H+ +O22-。
H+ +O22-。
編號 | 實驗 | 現象 |
Ⅰ | 向 1 mL pH=2 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 出現少量氣泡 |
Ⅱ | 向 1 mL pH=3 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即產生少量棕黃色沉淀,出現較明顯氣泡 |
Ⅲ | 向 1 mL pH=5 的 1 mol·L 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即產生大量棕褐色沉淀,產生大量氣泡 |
(1) 經檢驗生成的氣體均為 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化學方程式是__。
(2)對Ⅲ中棕褐色沉淀的成分提出 2 種假設:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。為檢驗上述假設,進行實驗Ⅳ:過濾Ⅲ中的沉淀,洗滌,加入過量硫酸,沉淀完全溶解,溶液呈藍色,并產生少量氣泡。
①若Ⅲ中生成的沉淀為 CuO2,其反應的離子方程式是__。
②依據Ⅳ中沉淀完全溶解,甲同學認為假設ⅱ不成立,乙同學不同意甲同學的觀點,理由是__。
③為探究沉淀中是否存在 Cu2O,設計如下實驗:
將Ⅲ中沉淀洗滌、干燥后,取 a g 固體溶于過量稀硫酸,充分加熱。冷卻后調節溶液 pH,以 PAN 為指示劑,向溶液中滴加 c mol·L 1EDTA 溶液至滴定終點,消耗 EDTA 溶液 V mL。V=__,可知沉淀中不含 Cu2O,假設ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol 1,M(Cu2O)=144 g·mol1)
(3)結合方程式,運用化學反應原理解釋Ⅲ中生成的沉淀多于Ⅱ中的原因__ 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 時 H2O2 分解速率不同的原因。
實驗Ⅴ:在試管中分別取 1 mL pHspan>=2、3、5 的 1 mol·L1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支試管中均無明顯現象。
實驗Ⅵ:__(填實驗操作和現象),說明 CuO2 能夠催化 H2O2 分解。
(5)綜合上述實驗,Ⅰ、Ⅱ、Ⅲ中不同 pH 時 H2O2 的分解速率不同的原因是__。
【答案】2H2O2 ![]() O2↑+2H2O H2O2+Cu2+=CuO2↓+2H+ CuO2與H+反應產生的H2O2具有強氧化性,在酸性條件下可能會氧化Cu2O或Cu,無法觀察到紅色沉淀Cu
O2↑+2H2O H2O2+Cu2+=CuO2↓+2H+ CuO2與H+反應產生的H2O2具有強氧化性,在酸性條件下可能會氧化Cu2O或Cu,無法觀察到紅色沉淀Cu ![]() 溶液中存在H2O2
溶液中存在H2O2![]() H+ +HO2-,HO2-
H+ +HO2-,HO2-![]() H+ +O22-,溶液pH增大,兩個平衡均正向移動,O22-濃度增大,使得CuO2沉淀量增大 將Ⅲ中沉淀過濾,洗滌,干燥,稱取少量于試管中,加入30%H2O2溶液,立即產生大量氣泡,反應結束后,測得干燥后固體的質量不變 CuO2的催化能力強于Cu2+;隨pH增大,Cu2+與H2O2反應生成CuO2增多
H+ +O22-,溶液pH增大,兩個平衡均正向移動,O22-濃度增大,使得CuO2沉淀量增大 將Ⅲ中沉淀過濾,洗滌,干燥,稱取少量于試管中,加入30%H2O2溶液,立即產生大量氣泡,反應結束后,測得干燥后固體的質量不變 CuO2的催化能力強于Cu2+;隨pH增大,Cu2+與H2O2反應生成CuO2增多
【解析】
(1)由題意可知,在硫酸銅做催化劑作用下,雙氧水分解生成水和氧氣,反應的化學方程式為2H2O2 ![]() O2↑+2H2O,故答案為:2H2O2
O2↑+2H2O,故答案為:2H2O2 ![]() O2↑+2H2O;
O2↑+2H2O;
(2)①若Ⅲ中生成的沉淀為CuO2,說明雙氧水與銅離子反應生成過氧化銅和水,反應的離子方程式為H2O2+Cu2+=CuO2↓+2H+,故答案為:H2O2+Cu2+=CuO2↓+2H+;
②由題意可知,過氧化銅能與溶液中氫離子反應生成雙氧水,雙氧水具有強氧化性,在酸性條件下可能會氧化氧化亞銅或銅,無法觀察到紅色沉淀,說明假設ⅱ可能成立,乙同學的觀點正確,故答案為:CuO2與H+反應產生的H2O2具有強氧化性,在酸性條件下可能會氧化Cu2O或Cu,無法觀察到紅色沉淀Cu;
③a g過氧化銅的物質的量為![]() ,由方程式可得如下關系:CuO2—Cu2+—EDTA,則有
,由方程式可得如下關系:CuO2—Cu2+—EDTA,則有![]() = c mol/L×V×10—3L,解得V=
= c mol/L×V×10—3L,解得V=![]() ml,故答案為:
ml,故答案為:![]() ;
;
(3)由題意可知,雙氧水溶液中存在如下電離平衡H2O2![]() H+ +HO2-、HO2-
H+ +HO2-、HO2-![]() H+ +O22-,溶液pH增大,氫離子濃度減小,兩個平衡均正向移動,過氧根濃度增大,使得過氧化銅沉淀量增大,故答案為:溶液中存在H2O2
H+ +O22-,溶液pH增大,氫離子濃度減小,兩個平衡均正向移動,過氧根濃度增大,使得過氧化銅沉淀量增大,故答案為:溶液中存在H2O2![]() H+ +HO2-,HO2-
H+ +HO2-,HO2-![]() H+ +O22-,溶液pH增大,兩個平衡均正向移動,O22-濃度增大,使得CuO2沉淀量增大;
H+ +O22-,溶液pH增大,兩個平衡均正向移動,O22-濃度增大,使得CuO2沉淀量增大;
(4)若過氧化銅能夠催化過氧化氫分解,過氧化氫分解速率加快,催化劑過氧化銅的組成和質量不會發生變化,則實驗操作和現象為將Ⅲ中沉淀過濾,洗滌,干燥,稱取少量于試管中,加入30%H2O2溶液,立即產生大量氣泡,反應結束后,測得干燥后固體的質量不變,故答案為:將Ⅲ中沉淀過濾,洗滌,干燥,稱取少量于試管中,加入30%H2O2溶液,立即產生大量氣泡,反應結束后,測得干燥后固體的質量不變;
(5)由以上實驗可知,當溶液pH增大時,雙氧水溶液中過氧根濃度增大,使得過氧化銅沉淀量增大,過氧化銅的催化能力強于銅離子,使雙氧水的分解速率增大,故答案為:CuO2的催化能力強于Cu2+;隨pH增大,Cu2+與H2O2反應生成CuO2增多。


 53天天練系列答案
53天天練系列答案科目:高中化學 來源: 題型:
【題目】環之間共用一個碳原子的化合物稱為螺環化合物,螺[2,2]戊烷(![]() )是最簡單的一種。下列關于該化合物的說法錯誤的是
)是最簡單的一種。下列關于該化合物的說法錯誤的是
A. 與環戊烯互為同分異構體
B. 二氯代物超過兩種
C. 所有碳原子均處同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離于方程式書寫正確的是
A. 加熱CuSO4溶液:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
B. 泡沫滅火器工作時的化學反應:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C. 以石墨為電極電解MgCl2溶液:2Cl-+2H2O![]() Cl2+H2↑+OH-
Cl2+H2↑+OH-
D. 向NH4HCO3溶液中加入過量的NaOH(溶液)加熱:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列熱化學方程式:2Zn(s) + O2(g) =2ZnO(s) ΔH1=-702.2kJ/mol
Hg(l) + ![]() O2(g) =HgO(s) ΔH2=-90.7kJ/mol
O2(g) =HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3 ,其中ΔH3的值是( )
A. -260.4 kJ/mol B. -254.6 kJ/mol
C. -438.9 kJ/mol D. -441.8 kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氨是氯氣遇到氨氣反應生成的一類化合物,是常用的飲用水二級消毒劑,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副產物少于其它水消毒劑。
回答下列問題:
(1)①一氯胺(NH2Cl)的電子式為__________。
②工業上可利用反應Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制備一氯胺,已知部分化學鍵的鍵能如下表所示(假設不同物質中同種化學鍵的鏈能相同),則該反應的△H=______________。
化學鍵 | N-H | Cl-Cl | N-Cl | H-Cl |
鍵能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
③一氯胺是重要的水消毒劑,其原因是由于一氯胺在中性、酸性環境中會發生水解,生成具有強烈殺菌作用的物質,該反應的化學方程式為_________________。
(2)用Cl2和NH3反應制備二氯胺的方程式為2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g),向容積均為1 L的甲、乙兩個恒溫(反應溫度分別為400℃、T℃)容器中分別加入2 mol C12和2 mol NH3,測得各容器中n(Cl2)隨反應時間t的變化情況如下表所示:
NHCl2(g)+2HCl(g),向容積均為1 L的甲、乙兩個恒溫(反應溫度分別為400℃、T℃)容器中分別加入2 mol C12和2 mol NH3,測得各容器中n(Cl2)隨反應時間t的變化情況如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min內用NH3的濃度變化表示的平均反應速率v(NH3)=______________。
②該反應的△H________0(填“>”或“<”) ,理由是____________________。
③對該反應,下列說法正確的是______________(填選項字母)。
A.若容器內氣體密度不變,則表明反應達到平衡狀態
B.若容器內C12和NH3物質的量之比不變,則表明反應達到平衡狀態
C.反應達到平衡后,其他條件不變,在原容器中充入一定量氦氣,Cl2的轉化率增大
D.反應達到平衡后,其他條件不變,加入一定量的NHCl2,平衡向逆反應方向移動
(3)在恒溫條件下,2molCl2和1molNH3發生反應2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),測得平衡時Cl
NHCl2(l)+2HCl(g),測得平衡時Cl

①A、B、C三點中Cl2轉化率最高的是______點(填“A”“B”或“C”)。
②計算C點時該反應的壓強平衡常數Kp(C)=_______(Kp是平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列各組物質中,互為同位素的是_____(填序號,下同),互為同系物的是_____,互為同分異構體的是_____。
①紅磷與白磷 ②35Cl與37Cl ③CH3COOCH3與CH3CH2COOCH3④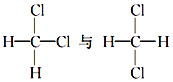 ⑤
⑤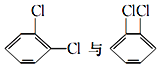 ⑥
⑥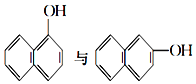 ⑦乙醇與二甲醚
⑦乙醇與二甲醚
(2)按系統命名法給下列有機物命名:
①CH3CH(C2H5)CH(CH3)2:_____。
②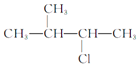 _____
_____
③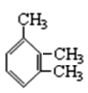 _____
_____
(3)寫出下列有機反應的方程式:
①1,3-丁二烯的加聚反應:_____
②3-甲基-2-丁醇的催化氧化反應:_____
③甲醛與新制氫氧化銅反應:_____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用如圖電解裝置將霧霾中的SO2、NO轉化為(NH4)2SO4,用其作為一種優良的氮肥。下列有關說法正確的是
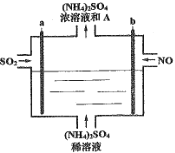
A.a與電源負極相連,發生還原反應
B.每處理lmolNO可以生成2molA
C.通電后陽極附近溶液的pH增大
D.理論上將SO2與NO以體積比2:5通入裝置可徹底轉化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中濃度關系正確的是( )
A. 小蘇打溶液中:c(Na+)+c(H+)=c(HCO)+c(CO![]() )+c(OH-)
)+c(OH-)
B. CH3COONa溶液中:c(CH3COO-)>c(Na+)
C. 物質的量濃度相等的CH3COOH溶液和CH3COONa溶液等體積混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D. 0.1 mol/L的NaHA溶液,其pH=4,則c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2O2分解速率受多種因素影響。實驗測得 70 ℃時不同條件下H2O2濃度隨時間的變化如圖所示。下列說法正確的是
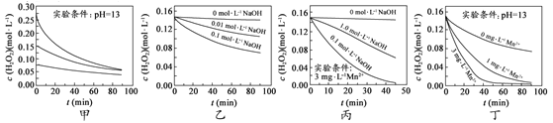
A.圖甲表明,其他條件相同時,H2O2濃度越小,其分解速率越快
B.圖乙表明,其他條件相同時,溶液pH越小,H2O2分解速率越快
C.圖丙表明,少量Mn 2+存在時,溶液堿性越強,H2O2分解速率越快
D.圖丙和圖丁表明,堿性溶液中,Mn2+對H2O2分解速率的影響大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com