
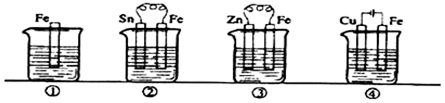
| A. | ③>②>④>① | B. | ④>②>①>③ | C. | ②>①>③>④ | D. | ④>②>③>① |
分析 先判斷裝置是原電池還是電解池,再根據原電池正負極腐蝕的快慢和電解池的陰陽極腐蝕快慢來比較,從而確定腐蝕快慢順序,電解原理引起的腐蝕>原電池原理引起的腐蝕>化學腐蝕>有防護腐蝕措施的腐蝕.
解答 解:根據圖知,②③裝置是原電池,在③中鋅比鐵活潑,金屬鐵做正極,②中金屬鐵比錫活潑,所以鐵作負極,而①發生化學腐蝕,速率較慢,做負極的腐蝕速率快,所以②>①>③,④裝置是電解池,其中金屬鐵為陽極,腐蝕速率最快,所以腐蝕速率是④>②>①>③,
故選B.
點評 本題考查了金屬腐蝕快慢判斷,為高頻考點,明確鐵發生的腐蝕類型及作何種電極即可解答,利用金屬腐蝕與防護,采取合適措施防止鐵被腐蝕,題目難度不大.


科目:高中化學 來源: 題型:選擇題
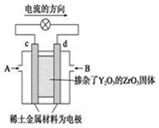
| A. | c電極是正極,發生還原反應 | |
| B. | B口通入的是甲烷,發生氧化反應 | |
| C. | 放電時O2-離子向d極移動 | |
| D. | d極上的電極反應式為:CH4+4O2-+8e-=CO2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 根據物質的組成元素是否單一,將純凈物分為單質和化合物 | |
| B. | 根據反應中的能量變化,將化學反應分為氧化還原反應、非氧化還原反應 | |
| C. | 根據電解質溶液導電能力強弱,將電解質分為強電解質、弱電解質 | |
| D. | 根據變化過程中是否有化學鍵的斷裂,將物質變化分為物理變化和化學變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
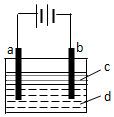 由于Fe(OH)2極易被氧化,所以實驗室難用亞鐵鹽溶液與燒堿反應制得白色純凈的Fe(OH)2沉淀.若用如圖所示實驗裝置可制得純凈的Fe(OH)2沉淀.兩極材料分別為石墨和鐵.
由于Fe(OH)2極易被氧化,所以實驗室難用亞鐵鹽溶液與燒堿反應制得白色純凈的Fe(OH)2沉淀.若用如圖所示實驗裝置可制得純凈的Fe(OH)2沉淀.兩極材料分別為石墨和鐵.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com