
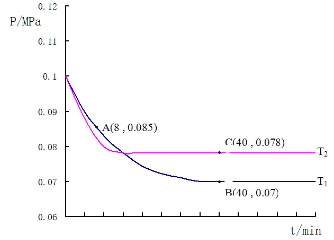
 SO2經過凈化后與空氣混合進行催化氧化后制取硫酸或者硫酸銨,其中SO2發生催化氧化的反應為:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa條件下,往一密閉容器通入SO2和O2(其中n(SO2):n(O2)=2:1),測得容器內總壓強與反應時間如圖所示:
SO2經過凈化后與空氣混合進行催化氧化后制取硫酸或者硫酸銨,其中SO2發生催化氧化的反應為:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa條件下,往一密閉容器通入SO2和O2(其中n(SO2):n(O2)=2:1),測得容器內總壓強與反應時間如圖所示:分析 ①反應平衡常數K=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$;
②結合化學三行計算列式,依據圖中A點時,氣體物質的量0.085,依據開始和A點氣體物質的量之比列式計算,轉化率=$\frac{消耗量}{起始量}$×100%;
③圖中B點,依據化學三行列式計算,設氧氣消耗物質的量為y,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
變化量(mol) 2y y 2y
平衡量(mol)2a-2y a-y 2y
B點氣體物質的量為 0.007,則
$\frac{2a-2y+a-y+2y}{2a+a}$=$\frac{0.07}{0.1}$
y=0.9a,
用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數計算SO2催化氧化反應在圖中B點的壓強平衡常數;
④先拐先平溫度高,達到平衡所需時間短,溫度越高反應速率越大;
解答 ①2SO2(g)+O2(g)?2SO3,反應的平衡常數K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$,
故答案為:$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$;
②依據化學三行列式計算,設氧氣消耗物質的量為x,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
變化量(mol) 2x x 2x
平衡量(mol)2a-2x a-x 2x
圖中A點時,氣體物質的量0.085,則
$\frac{2a-2x+a-x+2x}{2a+a}$=$\frac{0.085}{0.1}$
x=0.45a
SO2的轉化率=$\frac{0.45a×2}{2a}$×100%=45%,
故答案為:45%;
③圖中B點,依據化學三行列式計算,設氧氣消耗物質的量為y,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
變化量(mol) 2y y 2y
平衡量(mol)2a-2y a-y 2y
B點氣體物質的量為 0.007,則
$\frac{2a-2y+a-y+2y}{2a+a}$=$\frac{0.07}{0.1}$
y=0.9a,
平衡常數K=$\frac{(0.007MPa×\frac{1.8a}{0.2a+0.1a+1.8a})^{2}}{(0.007MPa×\frac{0.2a}{0.2a+0.1a+1.8a})^{2}×(0.007MPa×\frac{0.1a}{0.2a+0.1a+1.8a})}$=24300(MPa)-1,
故答案為:24300(MPa)-1;
④圖象分析可知,先拐先平溫度高則T1<T2,C點是平衡狀態,A點反應未達到平衡狀態,其中C點的正反應速率vC(正)與A點的逆反應速率vA(逆)的大小關系為vC(正)>vA(逆)
故答案為:<,>;
點評 本題考查了化學平衡、化學反應速率影響因素的分析應用,圖象變化和數值的計算是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
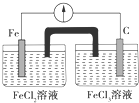
| A. | Fe是負極,C是正極 | B. | 負極反應式:Fe-3e-═Fe3+ | ||
| C. | 內電路中陰離子移向FeCl2溶液 | D. | 電流由石墨電極流向Fe電極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
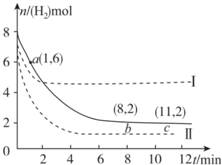 T℃時,6 mol CO2和 8 mol H2充入2 L密閉容器中,發生反應CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物質的量隨時間的變化如圖中實線所示.圖中虛線表示僅改變某一反應條件時,H2的物質的量隨時間的變化.下列說法正確的是( )
T℃時,6 mol CO2和 8 mol H2充入2 L密閉容器中,發生反應CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物質的量隨時間的變化如圖中實線所示.圖中虛線表示僅改變某一反應條件時,H2的物質的量隨時間的變化.下列說法正確的是( )| A. | 反應開始至a點時v(H2)=1 mol•L-1•min-1 | |
| B. | 若曲線Ⅰ對應的條件改變是升溫,則該反應△H>0 | |
| C. | 曲線Ⅱ對應的條件改變是減少壓強 | |
| D. | T℃時,該反應的化學平衡常數為0.125 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向鐵粉中加入一定量的稀硝酸 | |
| B. | 向MgSO4,H2SO4的混合液中滴入過量Ba(OH)2溶液 | |
| C. | 向NaOH溶液中通入一定量CO2氣體 | |
| D. | 將物質的量濃度之比為2:7的AlCl3和NaOH溶液等體積混合 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳原子既可以跟自身,又可以跟其他原子(如氫原子)形成4個共價鍵 | |
| B. | 碳原子性質活潑,可以跟多數元素原子形成共價鍵 | |
| C. | 碳原子之間既可以形成穩定的單鍵,又可以形成穩定的雙鍵和叁鍵 | |
| D. | 多個碳原子可以形成長度不同的鏈、支鏈及環,且鏈、環之間又可以相互結合 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
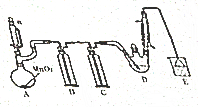 某探究小組設計如圖所示裝置(夾持、加熱儀器略)、模擬工業生產進行制備氯乙醛(CCl3CHO)的實驗,查閱資料,有關信息如圖所示:
某探究小組設計如圖所示裝置(夾持、加熱儀器略)、模擬工業生產進行制備氯乙醛(CCl3CHO)的實驗,查閱資料,有關信息如圖所示:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔點/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸點/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 與水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | MgCl2(熔融) $\frac{\underline{\;電解\;}}{\;}$ Mg+Cl2↑ | B. | Al2O3+3C $\frac{\underline{\;2125℃\;}}{\;}$2Al+3CO↑ | ||
| C. | Fe2O3+3CO $\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO2 | D. | HgS+O2$\frac{\underline{\;焙燒\;}}{\;}$ Hg+SO2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com