
| A. | 平衡常數(shù)減小 | B. | 物質(zhì)A的轉(zhuǎn)化率增加了 | ||
| C. | 平衡向正反應(yīng)方向移動(dòng)了 | D. | a>b |
分析 采用假設(shè)法分析,假設(shè)a=b,保持溫度不變,將容器體積增加一倍,平衡不移動(dòng),A和B的濃度應(yīng)均是原來的0.5倍,與達(dá)到新的平衡時(shí)B的濃度相比判斷平衡移動(dòng),再根據(jù)平衡移動(dòng)逐項(xiàng)判斷.
解答 解:采用假設(shè)法分析,假設(shè)a=b,保持溫度不變,將容器體積增加一倍,平衡不移動(dòng),A和B的濃度應(yīng)均是原來的0.5倍,但當(dāng)達(dá)到新的平衡時(shí),B的濃度是原來的40%,說明減小壓強(qiáng)平衡向逆反應(yīng)反應(yīng)方向移動(dòng).
A、因?yàn)槠胶獬?shù)僅與溫度有關(guān),所以將容器體積增加一倍,則平衡常數(shù)不變,故A錯(cuò)誤;
B、平衡時(shí)B的濃度是原來的40%,小于原來的0.5倍,說明平衡向逆反應(yīng)反應(yīng)方向移動(dòng),A的轉(zhuǎn)化率減小,故B錯(cuò)誤;
C、增大體積,壓強(qiáng)減小,平衡向逆反應(yīng)方向移動(dòng),故C錯(cuò)誤;
D、增大體積,壓強(qiáng)減小,平衡向逆反應(yīng)方向移動(dòng),則說明a>b,故D正確;
故選:D.
點(diǎn)評(píng) 本題考查化學(xué)平衡移動(dòng)問題,題目難度不大,注意通過改變體積濃度的變化判斷平衡移動(dòng)的方向,此為解答該題的關(guān)鍵.



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 2Na+2NH3═2NaNH2+H2↑ | B. | 2NH3+3CuO═3Cu+N2+3H2O | ||
| C. | NH3+H2O?NH3•H2O | D. | HCl+NH3═NH4Cl |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 稀硫酸與氫氧化鋇溶液反應(yīng):H++OH-═H2O | |
| B. | 碳酸氫鈉溶液與鹽酸反應(yīng):CO32-+2H+═CO2↑+H2O | |
| C. | 鋁與氫氧化鈉溶液反應(yīng):2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 鐵與氯化鐵溶液反應(yīng):Fe3+Fe═2Fe2+ |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 在同溫同壓時(shí),相同體積的任何氣體單質(zhì)所含的原子數(shù)目相同 | |
| B. | 標(biāo)準(zhǔn)狀況下,22.4 L水所含的水分子數(shù)為NA | |
| C. | 在常溫常壓下,11.2 L氮?dú)馑脑訑?shù)目為NA | |
| D. | 34g氨氣所含質(zhì)子數(shù)目為20 NA |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
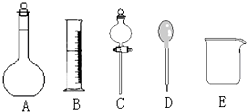 我校環(huán)保興趣小組在處理污水樣品時(shí),需用質(zhì)量分?jǐn)?shù)為36.5%的濃鹽酸(密度為1.19g/cm3)配制成240mL 0.1mol•L-1的鹽酸溶液.
我校環(huán)保興趣小組在處理污水樣品時(shí),需用質(zhì)量分?jǐn)?shù)為36.5%的濃鹽酸(密度為1.19g/cm3)配制成240mL 0.1mol•L-1的鹽酸溶液.查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
 納米材料TiO2在涂料、光催化、化妝品等領(lǐng)域有著極其廣泛的應(yīng)用.制備納米TiO2的方法之一是TiCl4在加熱條件下水解生成TiO2•xH2O,經(jīng)過過濾、水洗除去其中的Cl-,再經(jīng)烘干、焙燒除去水分,最后得到粉體TiO2.
納米材料TiO2在涂料、光催化、化妝品等領(lǐng)域有著極其廣泛的應(yīng)用.制備納米TiO2的方法之一是TiCl4在加熱條件下水解生成TiO2•xH2O,經(jīng)過過濾、水洗除去其中的Cl-,再經(jīng)烘干、焙燒除去水分,最后得到粉體TiO2.查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
 已知:①A是石油裂解氣的主要成份,A的產(chǎn)量通常用來衡量一個(gè)國(guó)家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化劑}$2CH3COOH.現(xiàn)以A為主要原料合成乙酸,其合成路線如圖所示.
已知:①A是石油裂解氣的主要成份,A的產(chǎn)量通常用來衡量一個(gè)國(guó)家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化劑}$2CH3COOH.現(xiàn)以A為主要原料合成乙酸,其合成路線如圖所示.
 .
.查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com