
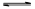 KI3
KI3| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
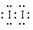 ②5I-+IO3—+6H+=3I2+3H2O、2Fe3++2I―
②5I-+IO3—+6H+=3I2+3H2O、2Fe3++2I― 2Fe2++I2。
2Fe2++I2。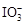 >Fe3+>I2”, 加足量KI后,
>Fe3+>I2”, 加足量KI后,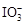 和Fe3+均能將I-氧化成I2,由此也可以知道該加碘鹽添加KIO3;第三份試液中加入適量KIO3固體后,滴加淀粉試劑,溶液不變色。由此可知該加碘鹽中不含KI。所以,①該加碘鹽溶液中加KSCN溶液顯紅色的物質是Fe(SCN)3; CCl4中顯紫紅色的物質是I2,電子式
和Fe3+均能將I-氧化成I2,由此也可以知道該加碘鹽添加KIO3;第三份試液中加入適量KIO3固體后,滴加淀粉試劑,溶液不變色。由此可知該加碘鹽中不含KI。所以,①該加碘鹽溶液中加KSCN溶液顯紅色的物質是Fe(SCN)3; CCl4中顯紫紅色的物質是I2,電子式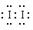 ②第二份試液中加入足量KI固體后,反應的離子方程式為:
②第二份試液中加入足量KI固體后,反應的離子方程式為: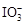 +5I-+6H+
+5I-+6H+ 3I2+3H2O ; 2Fe3++2I―
3I2+3H2O ; 2Fe3++2I― 2Fe2++I2。
2Fe2++I2。 KI3”,可以推出:KI3在常溫下不穩定性,受熱(或潮濕)條件下易分解為KI和I2 ,KI又易被空氣中的氧氣氧化,I2易升華,所以KI3·H2O作為食鹽加碘劑是不合適的。
KI3”,可以推出:KI3在常溫下不穩定性,受熱(或潮濕)條件下易分解為KI和I2 ,KI又易被空氣中的氧氣氧化,I2易升華,所以KI3·H2O作為食鹽加碘劑是不合適的。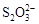 >I-”和氧化還原反應的強弱規律,可以選Na2S2O3作穩定劑;又由題給信息“3I2+6OH-
>I-”和氧化還原反應的強弱規律,可以選Na2S2O3作穩定劑;又由題給信息“3I2+6OH-
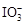 +5I-+3H2O”,可知I2與OH―會發生反應生成
+5I-+3H2O”,可知I2與OH―會發生反應生成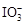 和5I-,而Na2CO3水解呈堿性,因而也可以用Na2CO3作穩定劑,防止加碘鹽(添加KI)在潮濕環境下被氧氣氧化。至于AlCl3,水解后呈酸性,且還原性I~ > Cl― ,所不能作穩定劑;NaNO2當遇強還原性物質時能表現出氧化性,所NaNO2與KI能發生氧化還原反應:2NO2-+ 2I―+ 4H+=" 2NO↑+" I2+2H2O ,不能作穩定劑。
和5I-,而Na2CO3水解呈堿性,因而也可以用Na2CO3作穩定劑,防止加碘鹽(添加KI)在潮濕環境下被氧氣氧化。至于AlCl3,水解后呈酸性,且還原性I~ > Cl― ,所不能作穩定劑;NaNO2當遇強還原性物質時能表現出氧化性,所NaNO2與KI能發生氧化還原反應:2NO2-+ 2I―+ 4H+=" 2NO↑+" I2+2H2O ,不能作穩定劑。

科目:高中化學 來源:不詳 題型:填空題
| A.酒精燈 | B.長直玻璃導管 | C.錐形瓶 | D.直型冷凝管 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.混合氣體中氯氣物質的量為0.04 mol |
| B.混合氣體中SO2物質的量為0.04 mol |
| C.所得的沉淀為0.1 mol BaSO4 |
| D.a的取值范圍為1.344< a <1.792 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.該反應中氧化劑是Cl2 |
| B.根據該反應可判斷還原性:S2O32- > Cl- |
| C.上述反應中,每生成l mol SO42-,轉移4 mol電子 |
| D.SO2與氯氣的漂白原理相同,所以也可以用SO2做紡織工業的漂白劑 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.化學方程式中按物質順序的計量數是:8、2、5、1、4、1、5 |
| B.反應中氧化產物是N2O |
| C.反應過程中轉移的電子數為8mol電子 |
| D.氧化產物和還原產物的物質的量之比為4∶1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| A.CuO | B.MnO2 | C.Fe2O3 | D.NaNO3 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.當有0.2 mol CO2生成時,溶液中陰離子的物質的量增加1mol |
| B.該反應中,每有2molCN-反應,轉移電子為10mol |
| C.上述反應中的還原劑是OH- |
| D.還原性:Cl-> CN- |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.亞硝酸鹽有強氧化性 |
| B.普通血紅蛋白有較強氧化性 |
| C.亞硝酸鹽中毒后,使用美藍,高鐵血紅蛋白被還原 |
| D.中毒與解毒過程中都發生了氧化還原反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com