

分析 I為紅褐色沉淀,為Fe(OH)3,由轉化關系可知,H為Fe(OH)2,G為FeCl2,B為Fe;金屬A能與鹽酸、氫氧化鈉溶液反應,A為金屬Al,E為白色沉淀,則E為Al(OH)3,由轉化關系可知,D為AlCl3,X為堿或水解為堿性的物質,F為Al2O3.
解答 解:I為紅褐色沉淀,為Fe(OH)3,由轉化關系可知,H為Fe(OH)2,G為FeCl2,B為Fe;金屬A能與鹽酸、氫氧化鈉溶液反應,A為金屬Al,E為白色沉淀,則E為Al(OH)3,由轉化關系可知,D為AlCl3,X為堿或水解為堿性的物質,F為Al2O3.
(1)由上述分析可知,F為Al2O3,G為FeCl2,故答案為:Al2O3,FeCl2;
(2)混合物為鐵與鋁,鐵具有磁性,可以利用磁鐵吸出鐵進行分離,故答案為:利用磁鐵吸出鐵;
(3)D→E的轉化為AlCl3→Al(OH)3,X為堿或水解為堿性的物質,加入過量的X,X不能是強堿,故X可能是氨水(或碳酸鈉、碳酸氫鈉、偏鋁酸鈉)等,故選:C;
(4)A→C為鋁與氫氧化鈉溶液反應生成偏鋁酸鈉與氫氣,離子方程式為:2Al+2OH-+2H2O=2AlO2-+3H2↑;
H→I為氫氧化亞鐵被氧化為氫氧化鐵,反應方程式為:4Fe(OH)2+O2+2H2O=4Fe(OH)3,現象是:產生的白色沉淀迅速變成灰綠色,最后變成紅褐色,
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3,產生的白色沉淀迅速變成灰綠色,最后變成紅褐色;
(5)檢驗FeCl2溶液中的陽離子的方法:取少G溶液于試管中,向試管中滴入幾滴KSCN溶液無現象,向的混合溶液中再加入氯水,溶液變成紅色,
故答案為:取少G溶液于試管中,向試管中滴入幾滴KSCN溶液無現象,向的混合溶液中再加入氯水,溶液變成紅色.
點評 本題以“無機框圖題”的形式考查無機物推斷、元素單質及其化合物的性質,難度中等,在熟練掌握元素化合物知識的基礎上著重考查學生的發散思維、分析判斷、邏輯思維以及對無機物知識的綜合應用等能力,I的顏色及金屬A能與鹽酸、氫氧化鈉溶液反應是推斷突破口.


 高效智能課時作業系列答案
高效智能課時作業系列答案科目:高中化學 來源: 題型:選擇題
| A. | 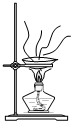 用裝置蒸發、結晶制取粗鹽 | B. | 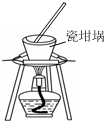 用裝置加熱熔融NaOH固體 | ||
| C. | 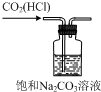 用裝置除去CO2中的少量HCl | D. | 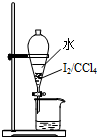 用裝置進行萃取、分液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.09mol | B. | 0.1 mol | C. | 0.2 mol | D. | 無法計算 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
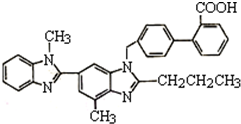 替米沙坦片是治療原發性高血壓的一種白色藥片,其主要成份為替米沙坦,化學結構如圖所示.下列關于替米沙坦的說法中錯誤的是( )
替米沙坦片是治療原發性高血壓的一種白色藥片,其主要成份為替米沙坦,化學結構如圖所示.下列關于替米沙坦的說法中錯誤的是( )| A. | 該物質屬于芳香族化合物 | |
| B. | 能發生加成反應、取代反應和酯化反應 | |
| C. | 替米沙坦的分子式為C32H28O2N4 | |
| D. | 能使酸性高錳酸鉀溶液褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
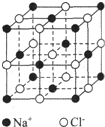
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 檢驗NH4+時,加濃NaOH溶液,加熱,用濕潤的紅色石蕊試紙放在試管口檢驗,若試紙變藍,則可證明原溶液中含有NH4+ | |
| B. | 檢驗SO42-時,加入BaCl2溶液,再加稀硝酸,若沉淀不消失,則可證明含SO42- | |
| C. | 用天平和小燒杯稱量5.40gNaOH固體 | |
| D. | 用飽和FeCl3溶液中逐滴滴加NaOH溶液,至溶液呈紅褐色即可制得Fe(OH)3膠體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
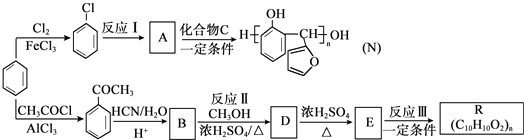

 .
. 生成
生成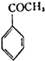 的反應類型是取代反應,D生成E的過程中,濃硫酸的作用催化劑和吸水劑.
的反應類型是取代反應,D生成E的過程中,濃硫酸的作用催化劑和吸水劑. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
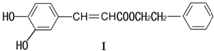
| A. | 遇FeCl3溶液可能顯紫色 | |
| B. | 可發生酯化反應和銀鏡反應 | |
| C. | 能與溴發生取代和加成反應 | |
| D. | 1mol化合物I最多能與2molNaOH反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com