在100℃時,將0.4mol的二氧化氮氣體充入2L抽真空的密閉容器中,每隔一定時間就對該容器內的物質進行分析,得到如下表數據:
| 時間(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.4 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0 |
0.05 |
n2 |
0.08 |
0.08 |
(1)在上述條件下,從反應開始直至20s時,二氧化氮的平均反應速率為______mol?L
-1?min
-1.
(2)n
3______n
4(填“>”、“<”或“=”),該反應的平衡常數的值為______;
(3)若在相同情況下最初向該容器充入的是四氧化二氮氣體,要達到上述同樣的平衡狀態,四氧化二氮的起始濃度是______mol/L.
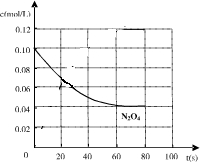
(4)假設從放入N
2O
4到平衡時需要80s,請在右圖中畫出并標明該條件下此反應中N
2O
4濃度隨時間變化的曲線.
(5)在(4)中條件下達到平衡后四氧化二氮的轉化率為______,混合氣體的平均摩爾質量為______g.mol
-1.
(6)達到平衡后,如升高溫度,氣體顏色會變深,則升高溫度后,反應2NO
2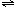
N
2O
4的平衡常數將______(填“增大”、“減小”或“不變”)
(7)達到平衡后,如向該密閉容器中再充入0.32molHe氣,并把容器體積擴大為4L,則平衡2NO
2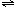
N
2O
4將______.(填“向左移動”、“向右移動”或“不移動”).
(8)達到平衡后,如果縮小容器的體積,則氣體的顏色變化是先變深后變淺,但比原來的顏色深,試用平衡移動原理解釋其變化的原因______.



 在100℃時,將0.40mol二氧化氮氣體充入2L抽空的密閉容器中,每隔一定時間就對該容器內的物質進行分析,得到如下表數據:
在100℃時,將0.40mol二氧化氮氣體充入2L抽空的密閉容器中,每隔一定時間就對該容器內的物質進行分析,得到如下表數據:

 非金屬元素氮有多種氧化物,如NO、NO2、N2O4等.
非金屬元素氮有多種氧化物,如NO、NO2、N2O4等.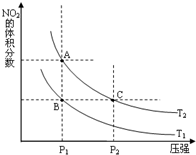 氮可形成多種氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互轉化.
氮可形成多種氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互轉化.