
【題目】用下圖所示實驗裝置進行相應實驗,能達到實驗目的的是( )

A. 用圖甲所示裝置,蒸干AlCl3飽和溶液制備AlCl3晶體
B. 按裝置乙所示的氣流方向可用于收集H2、NO等
C. 用圖丙所示裝置,分離CCl4萃取碘水后的有機層和水層
D. 用圖丁所示裝置,可以證明氧化性:Cl2>Br2>I2
【答案】C
【解析】
A、直接蒸干AlCl3飽和溶液,氯化氫揮發,導致水解平衡右移;
B、H2密度比空氣小,NO易與空氣中氧氣反應;
C、CCl4的密度比水大;
D、Cl2能和NaBr、KI發生置換反應生成Br2、I2。
A項、AlCl3為強酸弱堿鹽,在溶液中發生水解生成氫氧化鋁膠體和氯化氫,直接蒸干AlCl3飽和溶液,氯化氫揮發,導致水解平衡右移,使水解趨于完全生成氫氧化鋁沉淀,不能得到無水AlCl3,故A錯誤;
B項、H2密度比空氣小,應用向下排空法收集,氣體應短進長出,NO易與空氣中氧氣反應,不能用排空氣法收集,故B錯誤;
C項、CCl4的密度比水大,分離CCl4萃取碘水后的有機層在下層,水層在上層,與圖中裝置分層現象相符,故C正確;
D項、通入的Cl2能和NaBr、KI發生置換反應生成Br2、I2,無法確認Br2是否和KI反應,所以不能比較Br2和I2的非金屬性強弱,故D錯誤。
故選C。


科目:高中化學 來源: 題型:
【題目】用于金屬焊接的某種焊條,其藥皮由大理石、水泥、硅鐵等配制而成。
(1)Al的原子結構示意圖為____________;Al與NaOH溶液反應的離子方程式為____________。
(2)30Si的原子的中子數為________________________。SiO2的晶體類型為_____________。
(3)Al3+與Yn-的電子數相同,Y所在族各元素的氫化物的水溶液均顯酸性,則該族氫化物中沸點最低的是___________________。
(4)焊接過程中,藥皮在高溫下產生了熔渣和使金屬不被氧化的氣體,該氣體是____________。
(5)經處理后的熔渣36.0 g(僅含Fe2O3、Al2O3、SiO2),加入足量稀鹽酸,分離得到11.0 g固體;濾液中加入過量NaOH溶液,分離得到21.4 g固體;則此熔渣中Al2O3的質量分數為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘化鉀可用于有機合成、制藥等,它是一種白色立方結晶或粉末,易溶于水。實驗室制備KI 的實驗裝置如下

實驗步驟如下:
①在上圖所示的C中加入 127g 研細的單質I2 和 195g 30%的 KOH 溶液,劇烈攪拌。
②I2完全反應后,打開彈簧夾向其中通入足量的 H2S。
③將裝置 C 中所得溶液用稀 H2SO4酸化后,置于水浴上加熱 10min。
④在裝置 C 的溶液中加入 BaCO3 ,充分攪拌后,過濾、洗滌。
⑤將濾液用氫碘酸酸化,蒸發濃縮至表面出現結晶膜, 、 、洗滌、干燥。
⑥得產品 145g。
回答下列問題;
(1)步驟①將碘研細的目的是_____________________________________。
(2)裝置A 中發生反應的離子方程式為_______________________________ ;裝置 B 中的試劑是____________________,C裝置的名稱是_____________。
(3)裝置 C 中I2與 KOH 反應產物之一是 KIO3 ,該反應的化學方程式為_______________。
(4)步驟④的目的是___________________________________ 。
(5)補充完整步驟⑤ __________________、_______________。
(6)本次實驗產率為__________________ (保留四位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(11分)已知X、Y和Z三種元素的原子序數之和等于42。X元素原子的4p軌道上有3個未成對電子,Y元素原子的最外層2p軌道上有2個未成對電子。X跟Y可形成化合物X2Y3,Z元素可以形成負一價離子。請回答下列問題:
(1)X元素原子基態時的電子排布式為________,該元素的符號是________。
(2)Y元素原子的價層電子的電子排布圖為________,該元素的名稱是________。
(3)X與Z可形成化合物XZ3,該化合物的空間構型為________。
(4)已知化合物X2Y3在稀硫酸溶液中可被金屬鋅還原為XZ3,產物還有ZnSO4和H2O,該反應的化學方程式是___________________________________________________________。
(5)比較X的氫化物與同族第二、三周期元素所形成的氫化物穩定性、沸點高低并說明理由
_________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙醇是重要的化工原料,也是清潔的能源。
Ⅰ、工業上,在一定條件下用乙烯水化法制備乙醇。已知熱化學方程式如下:
①CH2=CH2(g)+H2O(g)CH3CH2OH(g) ΔH1
②2CH2=CH2(g)+H2O(g)CH3CH2OCH2CH3(g) ΔH2
③2CH3CH2OH(g)CH3CH2OCH2CH3(g)+H2O(g) ΔH3
(1)幾種化學鍵的鍵能如下:
化學鍵 | H-C | C=C | H-O | C-O | C-C |
鍵能kJ·mol-1 | 413 | 615 | 463 | 351 | 348 |
根據鍵能計算ΔH1=________________kJ·mol-1。
(2)在恒容密閉容器中發生反應②,下列能說明該反應達到平衡的是_________。
a、容器中總壓強保持不變
b、H2O(g)的消耗速率與CH3CH2OCH2CH3(g)生成速率相等
c、氣體平均摩爾質量保持不變
d、容器中氣體密度保持不變
(3)在密閉容器中投入CH2=CH2(g)、H2O(g)和催化劑發生反應①,乙烯的平衡轉化率與溫度、壓強的關系如圖所示。

①x代表________________。(選填“溫度”或“壓強”)
②L1和L2哪個大?并請說出理由:_____________________________________________________。
Ⅱ、如圖所示,甲、乙之間的隔板K和活塞F都可左右移動,甲中充入2molA和1molB,乙中充入2molC和lmolHe,此時K停在0處。在一定條件下發生可逆反應:2A(g)+B(g)2C(g);反應達到平衡后,再恢復至原溫度。回答下列問題:

(4)達到平衡時,隔板K最終停留在0刻度左側某一處,記為a處,則a的取值范圍是__________。
(5)若達到平衡時,隔板K最終停留在左側刻度1處,此時甲容積為2L,則該反應化學平衡常數為_______________。
(6)若一開始就將K、F如上圖固定,其他條件均不變,則達到平衡時:測得甲中A的轉化率為b,則乙中C的轉化率為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】加熱N2O5,依次發生分解反應:①N2O5(g)![]() N2O3(g)+O2(g)、②N2O3(g)
N2O3(g)+O2(g)、②N2O3(g)![]() N2O(g)+O2(g)。在體積為2 L的恒容密閉容器中充入8 mol N2O5,加熱到T ℃時反應達到平衡狀態,此時O2和N2O3的物質的量分別為9 mol、3.4 mol,則T ℃時反應①的平衡常數為
N2O(g)+O2(g)。在體積為2 L的恒容密閉容器中充入8 mol N2O5,加熱到T ℃時反應達到平衡狀態,此時O2和N2O3的物質的量分別為9 mol、3.4 mol,則T ℃時反應①的平衡常數為
A. 10.7 B. 8.5 C. 9.6 D. 10.2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)某溫度時,在2 L容器中X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖所示。由此分析,該反應的化學方程_____________________________________;從反應開始至2 min,Z的反應速率為_____ mol·L-1·min-1。

(2)若上述反應的△H<0,下列有關該反應速率的敘述,正確的是_________。
A.升高溫度和增大壓強均可以增大活化分子百分數,加快反應速率
B.使用催化劑可以使反應的活化能降低,加快反應速率
C.活化分子間所發生的碰撞為有效碰撞
D.降低溫度,v正、v逆均減小且v正減小的倍數小于v逆減小的倍數
(3)在一密閉容器中發生反應N2(g)+3H2(g)![]() 2NH3(g)△H<0,達到平衡后,只改變某一個條件時,反應速率與反應時間的關系如圖所示。 t1、t3、t4時刻分別改變的一個條件是:
2NH3(g)△H<0,達到平衡后,只改變某一個條件時,反應速率與反應時間的關系如圖所示。 t1、t3、t4時刻分別改變的一個條件是:
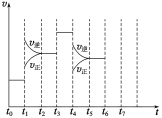
A.增大壓強 B.減小壓強 C.升高溫度 D.降低溫度 E.加催化劑 F.充入氦氣
t1時刻________;t3時刻________;t4時刻________(填字母)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法正確的是
A. 糖類都是天然高分子化合物,組成與結構比較復雜
B. 可以用酸性高錳酸鉀溶液鑒別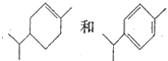
C. 體積分數為90%的乙醇溶液能使蛋白質變性,常用于醫療消毒
D. 甲苯的一溴代物和2一甲基丁烷的一溴代物都有4種(不考慮立體異構)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨技術的創立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的平衡常數K值和溫度的關系如表:
溫 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表數據可知該反應為_____ (填放熱,吸熱,無法確定 )反應。
②下列措施能用勒夏特列原理解釋是_____(填序號)。
a.增大壓強有利于合成氨 b.使用合適的催化劑有利于快速生成氨
c.生產中需要升高溫度至500°C左右 d.需要使用過量的N2,提高H2轉化率
(2)0.2mol氨氣溶于水后再與含有0.2mol硫酸的溶液反應放熱QkJ,請你用熱化學方程式表示其反應式_____。
(3)常溫時,將amol氨氣溶于水后,再通入bmol氯化氫,溶液體積為1L,且c(NH4+)=c(Cl﹣),則一水合氨的電離平衡常數Kb=_____(用ab表示)。
(4)原料氣H2可通過反應 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 獲取,已知該反應中,當初始混合氣中的
CO(g)+3H2(g) 獲取,已知該反應中,當初始混合氣中的![]() 恒定時,溫度、壓強對平衡混合氣CH4含量的影響如圖所示:
恒定時,溫度、壓強對平衡混合氣CH4含量的影響如圖所示:

①圖中,兩條曲線表示壓強的關系是:P1_____P2(填“>”、“=”或“<”)。
②其它條件一定,升高溫度,氫氣的產率會__(填“增大”,“減小”減小,“不變”不變)。
(5)原料氣H2還可通過反應CO(g)+H2O(g)![]() CO2(g)+H2(g)獲取。
CO2(g)+H2(g)獲取。
①T℃時,向容積固定為5L的容器中充入1mol水蒸氣和1mol CO,反應達平衡后,測得CO的濃度為0.08molL﹣1,該溫度下反應的平衡常數K值為_____。
②保持溫度仍為T℃,容積體積為5L,改變水蒸氣和CO的初始物質的量之比,充入容器進行反應,下列描述能夠說明體系處于平衡狀態的是_____(填序號)。
a.容器內壓強不隨時間改變
b.混合氣體的密度不隨時間改變
c.單位時間內生成a mol CO2的同時消耗a mol H2
d.混合氣中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com