
分析 鐵和硫酸銅反應生成硫酸亞鐵和銅,根據鐵片增加的質量可以計算反應的鐵的質量,根據金屬鐵和鹽酸之間的反應進行計算.
解答 解:設參加反應的鐵的質量為x,析出金屬銅的質量是y,
Fe+CuSO4═FeSO4+Cu,鐵片增加的質量
56 64 64-56=8
x y 9.2g-8.4g=0.8g
$\frac{56}{x}=\frac{8}{0.8}$=$\frac{64}{y}$,解得x=5.6g,y=6.4g,析出金屬銅物質的量是$\frac{6.4g}{64g/mol}$=0.1mol,剩余的鐵片質量是8.4g-5.6g=2.8g,物質的量是0.05mol,設產生氫氣物質的量是z,
Fe+2HCl=FeCl2+H2↑
1 2 1
0.05mol 0.1mol 0.05mol
所以產生氣體0.05mol,消耗鹽酸是0.1mol,故答案為:0.1;0.1;0.05.
點評 差量法在計算中的應用很廣泛,解答的關鍵是要分析出物質的質量差與要求的未知數之間的關系,再根據具體的數據求.


 探究與鞏固河南科學技術出版社系列答案
探究與鞏固河南科學技術出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 向硫酸銨溶液中滴加氫氧化鋇溶液:Ba2++SO42-=BaSO4↓ | |
| B. | 鈉跟水反應:Na+2H2O=Na++2OH-+H2↑ | |
| C. | AlCl3溶液中加入過量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | |
| D. | 用NaOH溶液吸收少量Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 氣體發生裝置 | 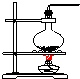 a |  b | 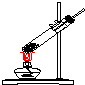 c |
| 氣體收集裝置 | 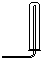 ① |  ② | 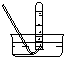 ③ |

查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com