
以硫鐵礦(主要成分為FeS2)為原料制備氯化鐵晶體(FeCl3·6H2O)的工藝流程如下:
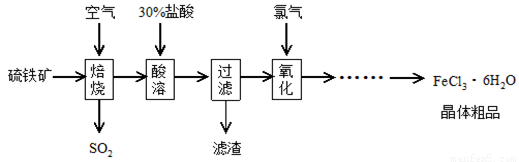
回答下列問題:
(1)焙燒硫鐵礦的主要方程式為 。
(2)酸溶及后續過程中均需保持鹽酸過量,其目的是提高鐵元素的浸出率、 。
(3)通氯氣氧化后時,發生的主要反應的離子方程式為 ;該過程產生的尾氣可用堿溶液吸收,尾氣中污染空氣的氣體為(寫化學式) 。
(4)在氧化過程中,如何檢驗鐵元素全部以Fe3+形式存在: 。
(5)如果將氯化鐵晶體(FeCl3·6H2O)放在坩堝中加熱灼燒,最后得到的固體為 。
(6)在一定條件下,SO2轉化為SO3的反應為2SO2(g)+O2(g) 2SO3(g),該反應的平衡常數表達式為K=
;
工業在接觸法制硫酸的生產中,采取下列哪些措施有利于提高SO2轉化率 。
2SO3(g),該反應的平衡常數表達式為K=
;
工業在接觸法制硫酸的生產中,采取下列哪些措施有利于提高SO2轉化率 。
①V2O5作崔化劑 ②通入過量O2 ③SO2、O2進行二次氧化 ④通入過量SO2
(1)4 FeS2 + 11 O2 2 Fe2O3 + 8SO2(2分)
2 Fe2O3 + 8SO2(2分)
(2)抑制Fe3+水解(2分)
(3)Cl2+Fe2+=2Cl-+Fe3+ (2分) Cl2 HCl(2分)
(4)取氧化后的溶液少許于試管中,往試管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫紅色不褪去,說明鐵元素全部以Fe3+形式存在。(2分)
(5)Fe2O3(2分)
(6)k=c2(SO3)/c(O2)·c2(SO2) (2分) ②③(2分)
【解析】
試題分析:(1)焙燒硫鐵礦是硫酸工業中制取二氧化硫氣體的重要步驟,發生的氧化還原反應配平比較困難,利用電子得失守恒配平得: 4 FeS2 + 11 O2 2 Fe2O3 + 8SO2(2分)
2 Fe2O3 + 8SO2(2分)
(2)酸溶焙燒產物不僅是提高浸出率,還可以抑制溶解得到的Fe3+水解。
(3)因為最終要得到的產品是氯化鐵晶體,所以可能焙燒不完全,仍有部分亞鐵離子,所以加入氧化劑氯氣氧化除去,發生的反應為Cl2+Fe2+=2Cl-+Fe3+ ,該過程可能有氯氣溶于水產生揮發性的HCl以及過量的Cl2,所以可以用堿吸收。
(4)檢驗是否全部轉化為Fe3+ ,就是檢驗Fe2+ 的存在,所以檢驗Fe2+ 可以使用高錳酸鉀試劑,所以操作為:取氧化后的溶液少許于試管中,往試管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫紅色不褪去,說明鐵元素全部以Fe3+形式存在。
(5)氯化鐵晶體(FeCl3·6H2O)含有水分,所以加熱灼燒過程中,FeCl3 會發生水解并最終得到穩定的氧化物Fe2O3 。
(6)根據方程式可以寫出平衡常數表達式為k=c2(SO3)/c(O2)·c2(SO2);要提高SO2 的轉化率,則需要使平衡正向移動或SO2 二次利用,所以可行的是② 、③。
考點:本題考查的是工業制硫酸和化學反應原理知識。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:

| ||
| △ |
| c2(SO3) |
| c(O2)c2(SO2) |
| c2(SO3) |
| c(O2)c2(SO2) |
查看答案和解析>>
科目:高中化學 來源: 題型:
(18分)以硫鐵礦(主要成分為FeS2)為原料制備氯化鐵晶體(FeCl3·6H2O)的工藝流程如下:
回答下列問題:
(1)將煅燒黃鐵礦的化學方程式補充完整: + Fe2O3+ SO2↑;該反應中,FeS2為 劑;SO2為 產物,其常常用于制備硫酸,反應過程中的化學反應方程式為 、 ;
(2)酸溶及后續過程中均需保持鹽酸過量,其目的是 、 ;
(3)通氯氣氧化后時,發生的主要反應的離子方程式為 ;
(4)該過程產生的污染空氣的氣體有三種,尾氣均可用強堿溶液吸收,這些反應的離子方程式為 ;。
(5)從FeCl3溶液中得到FeCl3.6H2O晶體的操作為 。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年海南省瓊海市高三第一學期教學質量監測(三)化學試卷 題型:填空題
(12分)以硫鐵礦(主要成分為FeS2)為原料制備氯化鐵晶體(FeCl3·6H2O)的工藝流程如下:
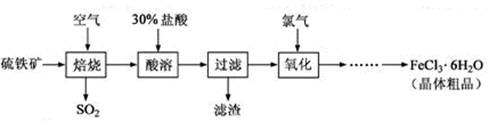
回答下列問題:
(1) 在一定條件下,SO2轉化為SO3的反應為2SO2(g)+O2(g) 2SO3(g),該反應的平衡常數表達式為K= ;過量的SO2與NaOH溶液反應的化學方程式為 。
2SO3(g),該反應的平衡常數表達式為K= ;過量的SO2與NaOH溶液反應的化學方程式為 。 (2)酸溶及后續過程中均需保持鹽酸過量,其目的是
、
。
(2)酸溶及后續過程中均需保持鹽酸過量,其目的是
、
。
(3)通氯氣氧化時,發生的主要反應的離子方程式為 ;
該過程產生的尾氣可用堿溶液吸收,尾氣中污染空氣的氣體為
(寫化學式)。
查看答案和解析>>
科目:高中化學 來源:2011年普通高等學校招生全國統一考試化學卷(江蘇) 題型:填空題
以硫鐵礦(主要成分為FeS2)為原料制備氯化鐵晶體(FeCl3·6H2O)的工藝流程如下:
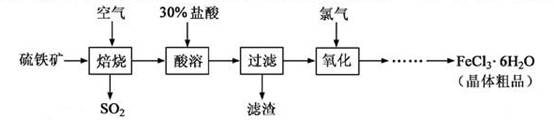
回答下列問題:
(1)在一定條件下,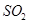 轉化為
轉化為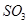 的反應為
的反應為 ,該反應的平衡常數表達式為K= ;過量的
,該反應的平衡常數表達式為K= ;過量的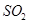 與
與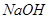 溶液反應的化學方程式為
溶液反應的化學方程式為
(2)酸溶及后續過程中均需保持鹽酸過量,其目的是 、 。
(3)通氯氣氧化后時,發生的主要反應的離子方程式為 ;該過程產生的為其可用堿溶液吸收,為其中污染空氣的氣體為 (寫化學)。
查看答案和解析>>
科目:高中化學 來源:2012屆江蘇省高二第二學期期末考試化學試卷 題型:填空題
(12分)以硫鐵礦(主要成分為FeS2)為原料制備氯化鐵晶體(FeCl3·6H2O)的工藝流程如下:
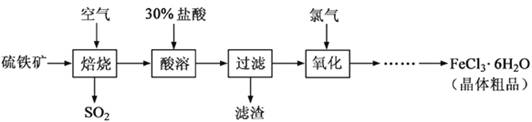
回答下列問題:
(1)硫鐵礦高溫焙燒的化學方程式為 ; 少量的SO2與NaOH溶液反應的離子方程式為 。
(2)酸溶及后續過程中均需保持鹽酸過量,其目的是提高鐵元素的浸出率和 ,
題問所涉及反應的離子方程式為 。
(3)通氯氣氧化時,發生的主要反應的離子方程式為 ;該過程產生的尾氣可用堿溶液吸收,尾氣中污染空氣的氣體為 (寫化學式)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com