
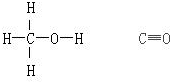
| 化學鍵 | H-H | C-O | C≡O | H-O | C-H |
| 鍵能(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
分析 (1)反應熱=反應物總鍵能-生成物總鍵能;
(2)依據化學平衡三段式列式計算,經過10min后達到平衡狀態.若此時測得CH3OH蒸氣的濃度為0.5mol/L.物質的量為0.5L×2mol/L=1mol;
3H2(g)+?CO2(g)?CH3OH(g)+H2O(g)
起始量(mol) 4 2 0 0
變化量(mol) 3 1 1 1
平衡量(mol) 1 1 1 1
據此計算反應速率V=$\frac{△c}{△t}$,
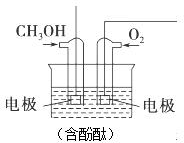
(3)通入甲醇的電極是負極,反應時該電極反應:CH3OH+8OH--6e-=CO32-+6H2O,故溶液紅色變淺;該燃料電池工作時,陽離子向正極移動,電解質溶液為堿性,所以電池正極的電極反應式為:O2+2H2O+4e-=4OH-;根據串聯電路中轉移電子相等計算消耗氧氣的量;
解答 解:(1)反應熱=反應物總鍵能-生成物總鍵能,故△H=1076kJ.mol-1+2×436kJ.mol-1-(3×413+343+465)kJ.mol-1=-99kJ.mol-1;
故答案為:放出; 99
(2)經過5min后達到平衡狀態.若此時測得CH3OH蒸氣的濃度為0.5mol/L.物質的量為0.5L×2mol/L=1mol;
3H2(g)+?CO2(g)?CH3OH(g)+H2O(g)
起始量(mol) 4 2 0 0
變化量(mol) 3 1 1 1
平衡量(mol) 1 1 1 1
據此計算以H2的濃度變化表示的該反應反應速率V=$\frac{\frac{3mol}{2L}}{10min}$=0.15mol/(L•min),
故答案為:0.15mol/(L•min);
(3)通入甲醇的電極是負極,反應時該電極反應:CH3OH+8OH--6e-=CO32-+6H2O,故溶液紅色變淺;該燃料電池工作時,陽離子向正極移動,氧氣在堿性電解質溶液中得電子,所以電池正極的電極反應式為:O2+2H2O+4e-=4OH-,電池工作過程中通過2mol電子,則理論上消耗O2的體積=$\frac{2mol}{4}$×22.4L/mol=11.2L
故答案為:負;溶液紅色變淺;正;O2+2H2O+4e-=4OH-;11.2L.
點評 本題考查了原電池原理,涉及電極反應式的書寫、熱化學反應方程式、物質的量的計算等知識點,這些知識點都是考試熱點,根據串聯電路中轉移電子相等進行計算,難點是電極反應式的書寫,題目難度中等.


 高中必刷題系列答案
高中必刷題系列答案科目:高中化學 來源: 題型:解答題
溫度/K | 298 | 398 | 498 | … |
| 平衡常數(K) | 4.1×105 | K1 | K2 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 化學鍵 | C-H | C-C | C═C | H-H |
| 鍵能/kJ•mol-1 | 412 | 348 | 612 | 436 |
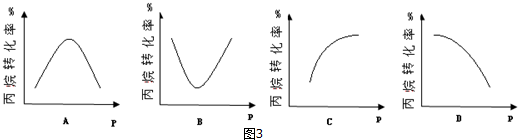
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
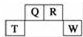 短周期元素Q、R、T、W在元素周期表中的位置如圖所示,其中T所處的周期序數與主族序數相等,請回答下列問題:
短周期元素Q、R、T、W在元素周期表中的位置如圖所示,其中T所處的周期序數與主族序數相等,請回答下列問題: .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/K | 反應I | 反應Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
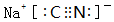 .
.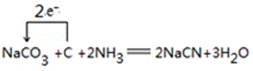 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 托盤天平 | B. | 膠頭滴管 | C. | 250 mL容量瓶 | D. | 量筒 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com