
某反應中反應物與生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)將上述反應設計成的原電池如圖甲所示,請回答下列問題:

①圖中X溶液是_____________________________;
②石墨電極上發(fā)生的電極反應式為__________________________________________;
③原電池工作時,鹽橋中的____________(填“K+”或“Cl-”)不斷進入X溶液中。
(2)將上述反應設計成的電解池如圖乙所示,乙燒杯中金屬陽離子的物質的量與電子轉移的物質的量的變化關系如圖丙,請回答下列問題:
①M是__________極;
②圖丙中的②線是______________的變化。
③當電子轉移為2 mol時,向乙燒杯中加入________ L 5 mol·L-1 NaOH溶液才能使所有的金屬陽離子沉淀完全。
(3)鐵的重要化合物高鐵酸鈉(Na2FeO4)是一種新型飲用水消毒劑,具有很多優(yōu)點。
①高鐵酸鈉生產方法之一是電解法,其原理為Fe+2NaOH+2H2O=Na2FeO4+3H2↑,則電解時陽極的電極反應式是__________________________________。
②高鐵酸鈉生產方法之二是在強堿性介質中用NaClO氧化Fe(OH)3生成高鐵酸鈉、氯化鈉和水,該反應的離子方程式為_______________________________________。
(1) ①FeCl3、FeCl2 ②Fe3++e-=Fe2+ K+ (1分)
(2)①負(1分) ②Fe2+ ③2.8
(3)
解析試題分析:(1)①參照反應的自發(fā)性,Cu只能和FeCl3反應。②為正極,F(xiàn)e3++e-=Fe2+③陽離子向正極移動。(2)參照圖像中與電子的關系,可以發(fā)現(xiàn)③時銅的變化量,所以Cu作陽極。則石墨作陰極。②線與 電子關系是1:1,可以推出是Fe2+。當電子為2mol時,陽離子有Cu2+ 1mol,Fe3+ 2mol Fe2+ 3mol.共需要OH- 14mol,溶液體積為2.8L。(3)①Fe+8OH--6e-=FeO42-+4H2O②2Fe(OH)3+3ClO-+4OH-=2=FeO42-+3Cl-+5H2O
考點:電化學相關基本知識和利用電子,電性,原子守恒相關知識書寫電化學反應方程式。


科目:高中化學 來源: 題型:填空題
電浮選凝聚法處理酸性污水的工作原理如圖所示。下列說法不正確的是
A.鐵電極的電極反應式為: |
B.通人空氣的石墨電極的電極反應式為 |
| C.若左池石墨電極產生44. 8L(標準狀況)氣體,則消耗氧氣0. 5mol |
| D.為增強污水的導電能力,可向污水中加入適量工業(yè)用食鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
電解原理在化學工業(yè)中有廣泛應用。如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連。請回答以下問題:
(1)若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則
① 電解池中X極上的電極反應式為 。在X極附近觀察到的現(xiàn)象是 。
② Y電極上的電極反應式為 ,檢驗該電極反應產物的方法是 。
(2)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,則
① X電極的材料是 ,電極反應式是 。
② Y電極的材料是 ,電極反應式是 。
(說明:雜質發(fā)生的電極反應不必寫出)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某化學興趣小組用下圖裝置電解CuSO4溶液,測定銅的相對分子質量。
(1)若實驗中測定在標準狀況下放出的氧氣的體積VL,A連接直流電源的__________ (填“正極”或“負極”)。
(2)電解開始一段時間后,在U形管中可觀察到的現(xiàn)象-____________________________。
電解的離子方程式為 。
(3)實驗中還需測定的數(shù)據(jù)是_______________(填寫序號)。
①A極的質量增重m g ②B極的質量增重m g
(4)下列實驗操作中必要的是____________(填字母)。
| A.稱量電解前電極的質量 |
| B.電解后,電極在烘干稱重前,必須用蒸餾水沖洗 |
| C.刮下電解過程中電極上析出的銅,并清洗、稱重 |
| D.電極在烘干稱重的操作中必須按“烘干—稱重一再烘干一再稱重”進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分)電解原理和原電池原理是電化學的兩個重要內容。某興趣小組做如下探究實驗: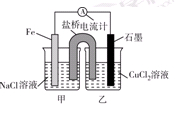
Ⅰ.(1)如圖為某實驗小組依據(jù)氧化還原反應:(用離子方程式表示)_______________________________設計的原電池裝置,反應前,電極質量相等,一段時間后,兩電極質量相差12 g,導線中通過________mol電子。
(2)其他條件不變,若將CuCl2溶液換為NH4Cl溶液,石墨電極反應式為________________________,這是由于NH4Cl溶液顯________(填“酸性”“堿性”或“中性”),用離子方程式表示溶液顯此性的原因____________________________________________。
(3)如圖其他條件不變,若將鹽橋換成彎銅導線與石墨相連成n型,則乙裝置中石墨(1)為________極(填正、負、陰、陽),乙裝置中與銅線相連石墨電極上發(fā)生的反應式為_________________________________。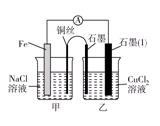
Ⅱ.如右圖所示裝置,通電5 min后,第③極增重2.16 g,同時在A池中收集到標準狀況下的氣體224 mL。
請完成下列問題: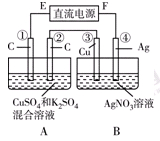
①第②極上生成的物質為________mol。
②寫出第①極上發(fā)生反應的電極反應式_________________________。
③設A池中原混合液的體積為200 mL,則通電前A池原混合液中Cu2+的濃度為________ mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
根據(jù)銅鋅原電池示意圖,回答下列問題:
(1)鋅為 極,電極反應式為 ;銅為 極,電極反應 為 ,原電池總離子反應式是 。
(2)若以該電池作為電源,以石墨碳棒為電極電解CuCl2溶液,在電池的工作過程中,Zn極質量變化了3.25g,則Cu極質量 (填“增加”、“不變”或“減少”);電子從電池的鋅極沿導線流向電解池的 (填“陰極”或“陽極”,下同);在電解池中Cu2+向 移動,在該電極上析出銅的質量為 g。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某水溶液中含有等物質的量濃度的Cu(NO3)2和MgCl2,對該溶液以惰性電極進行電解,分階段寫出電解反應的化學方程式。
第一階段的反應:______________________________________________________________________;
第二階段的反應:______________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業(yè)上以鋰輝石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)為原料生產碳酸鋰。其部分工藝流程如下: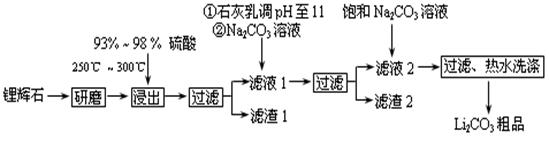
已知:①Li2O·Al2O3·4SiO2 + H2SO4(濃) Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(12分)如圖所示,某同學設計了一個燃料電池并探究氯堿工業(yè)原理和粗銅的精煉原理,其中乙裝置中X為陽離子交換膜。請按要求回答相關問題: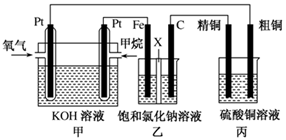
(1)甲烷燃料電池負極反應式是 ;
(2)石墨(C)極的電極反應式為 ;
(3)若在標準狀況下,有2.24 L氧氣參加反應,則乙裝置中鐵極上生成 的氣體體積為________L ,丙裝置中陰極析出銅的質量為________g ;
(4)某同學利用甲烷燃料電池設計電解法制取漂白液或Fe(OH)2的實驗裝置(如圖所示)。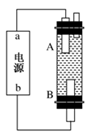
若用于制漂白液,a為電池的________極,電解質溶液最好用________;若用于制Fe(OH)2,使用硫酸鈉作電解質溶液,陽極選用________作電極。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com