
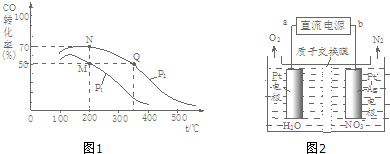
分析 (1)據已知熱化學方程式,利用蓋斯定律解答;
(2)①M點時,CO轉化率為50%,則參加反應的n(CO)=10mol×50%=5mol,還剩余5molCO,根據方程式知,還剩余n(H2)=20mol-5mol×2=10mol,生成n(CH3OH)=5mol;N點時,CO轉化率為70%,參加反應的n(CO)=10mol×70%=7mol,還剩余3molCO,根據方程式知,還剩余n(H2)=20mol-7mol×2=6mol,生成n(CH3OH)=7mol,據此計算其物質的量之比;
相同溫度下,化學平衡常數相等,據此計算兩個容器體積之比;
②化學平衡常數只與溫度有關,相同溫度時其平衡常數相等,升高溫度平衡向逆反應方向移動,其平衡常數減小;
(3)①用H2將NO3-還原為N2,一段時間后,溶液的堿性明顯增強,說明該反應中生成氫氧根離子;
②根據圖象知,硝酸根離子得電子發生還原反應,則b為負極、a為正極,根據電池反應式知,陰極上硝酸根離子得電子生成氮氣和水;
(4)①若將Cr2O72-轉化為Cr(OH)3沉淀除去,必須將Cr從+6價還原為+3價;
②據Ksp[Fe(OH)2]1×10-15、Ksp[Cr(OH)3]=1×10-23,計算其pH.
解答 解:(1)已知①H2(g)+1/2O2(g)═H2O(g)△H1=-241.8kJ•mol-1
②C(s)+1/2O2(g)═CO(g)△H2=-110.5kJ•mol-1
據蓋斯定律,②-①得:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1,
故答案為:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1;
(2)①M點時,CO轉化率為50%,則參加反應的n(CO)=10mol×50%=5mol,還剩余5molCO,根據方程式知,還剩余n(H2)=20mol-5mol×2=10mol,生成n(CH3OH)=5mol;N點時,CO轉化率為70%,參加反應的n(CO)=10mol×70%=7mol,還剩余3molCO,根據方程式知,還剩余n(H2)=20mol-7mol×2=6mol,生成n(CH3OH)=7mol,所以容器中總物質的物質的量之比為:n(M)總:n(N)總=(5+10+5)mol:(3+6+7)mol=5:4,故答案為:5:4;
②化學平衡常數只與溫度有關,相同溫度時其平衡常數相等,升高溫度平衡向逆反應方向移動,其平衡常數減小,根據圖象知,溫度:M=N<Q,則若M、N、Q三點的平衡常數KM、KN、KQ的大小關系為KM=KN>KQ,故答案為:KM=KN>KQ;
(3)①用H2將NO3-還原為N2,一段時間后,溶液的堿性明顯增強,說明該反應中生成氫氧根離子,同時還生成水,所以反應方程式為2NO3-+5H2$\frac{\underline{\;催化劑\;}}{\;}$N2+2OH-+4H2O,故答案為:2NO3-+5H2$\frac{\underline{\;催化劑\;}}{\;}$N2+2OH-+4H2O;
②根據圖象知,硝酸根離子得電子發生還原反應,則b為負極、a為正極,根據電池反應式知,陰極上硝酸根離子得電子生成氮氣和水,電極反應式為2NO3-+12H++10e-=N2+6H2O,故答案為:a;2NO3-+12H++10e-=N2+6H2O;
(4)①若將Cr2O72-轉化為Cr(OH)3沉淀除去,必須將Cr從+6價還原為+3價,加入綠礬(FeSO4•7H2O)的目的是還原6價Cr,反應的離子方程式為:Cr2O72-+6 Fe2++14H+=6Fe3++2Cr3++7H2O,故答案為:Cr2O72-+6 Fe2++14H+=6Fe3++2Cr3++7H2O;
②Ksp[Fe(OH)2]1×10-15,Fe2+開始沉淀時,c(Fe2+ )=0.1mol/L,溶液的pH=7.0;完全沉淀時,c(Fe2+)=1×10-5 mol/L時,溶液的pH=9.0;
Ksp[Cr(OH)3]=1×10-23,Cr3+開始沉淀時,c(Cr 3+ )=10.0mol/L時,c(OH-)=1×10-8 mol/L,pH=6.0;完全沉淀時,c(Cr 3+ )=1×10 -5 mol/L時,溶液的pH=8.0;故二者共沉淀的pH范圍是7.0~8.0,
故答案為:7.0~8.0.
點評 本題考查化學平衡及電解原理,知道化學平衡狀態判斷方法、溫度與化學平衡常數的關系、外界條件對化學平衡的影響、電解原理等知識點分析解答即可,注意(1)③中根據化學平衡常數計算容器體積之比,注意:只有反應前后改變的物理量才能作為化學平衡狀態的判斷依據,題目難度中等.


科目:高中化學 來源: 題型:選擇題
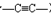 )組成的混合氣體與足量的H2反應,充分加成后,生成4.4g3種對應的烷徑中一定有( )
)組成的混合氣體與足量的H2反應,充分加成后,生成4.4g3種對應的烷徑中一定有( )| A. | 乙炔 | B. | 乙烷 | C. | 丙炔 | D. | 丙烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用濕潤的pH試紙測定某稀醋酸溶液的pH | |
| B. | 做完銀鏡反應的試管可以用氨水來洗滌 | |
| C. | 為了除去苯中混有的少量苯酚,加入足量濃溴水,充分攪拌后過濾分離 | |
| D. | 如果苯酚濃溶液沾到皮膚上,應立即用酒精擦洗 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 范德華力是決定由分子構成物質熔、沸點高低的惟一因素 | |
| B. | 范德華力與物質的性質沒有必然的聯系 | |
| C. | 范德華力能夠影響物質的化學性質和物理性質 | |
| D. | 范德華力僅是影響物質部分物理性質的一種因素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
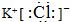 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 30.8% | B. | 28.6% | C. | 25.3% | D. | 22.7% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com