
分析 在一定溫度下,將2molA和2molB兩種氣體相混合后于容積為2L的某密閉容器中,2min末反應達到平衡狀態,生成了0.8molD,并測得C的濃度為0.4mol/L,生成C為0.4mol/L×2=0.8mol,則:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):2 2 0 0
變化量(mol):1.2 0.8 0.8 0.8
平衡量(mol):0.8 1.2 0.8 0.8
(1)平衡時C的濃度為0.4mol/L,則n(C)=0.4mol/L×2L=0.8mol,結合n(D)利用物質的量之比等于化學計量數之比計算x.
(2)根據平衡時n(D),由方程式可知參加反應的n(A)=$\frac{3}{2}$n(D),再根據轉化率定義計算A的轉化率.
(3)依據反應速率概念計算v=$\frac{△c}{△t}$;
(4)反應前后氣體體積不變,增大壓強平衡不動.
解答 解:在一定溫度下,將2molA和2molB兩種氣體相混合后于容積為2L的某密閉容器中,2min末反應達到平衡狀態,生成了0.8molD,并測得C的濃度為0.4mol/L,生成C為0.4mol/L×2=0.8mol,則:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):2 2 0 0
變化量(mol):1.2 0.8 0.8 0.8
平衡量(mol):0.8 1.2 0.8 0.8
(1)平衡時C的濃度為0.4mol/L,則n(C)=0.4mol/L×2L=0.8mol,物質的量之比等于化學計量數之比,所以0.8mol:0.8mol=x:2,解得x=2.
故答案為:2;
(2)平衡時n(D)=0.8mol,由方程式可知參加反應的n(A)=$\frac{3}{2}$n(D)=$\frac{3}{2}$×0.8mol=1.2mol,故A的轉化率為$\frac{1.2mol}{2mol}$×100%=60%.
故答案為:60%;
(3)生成D的反應速率=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/L•min;
故答案為:0.2mol/L•min;
(4)反應前后氣體的物質的量不變,增大壓強,平衡不移動,平衡體系中C的質量分數不變,
故答案為:不變.
點評 本題考查化學平衡計算與影響因素等知識,為高考常見題型,側重于學生的分析能力和計算能力的考查,注意體會三段式法的運用,難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 盡可能使用稀溶液 | B. | 選擇合適的催化劑 | ||
| C. | 碾細固體反應物 | D. | 提高反應體系的溫度 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
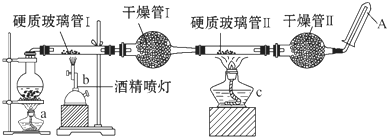 在常溫下,Fe與水并不起反應,但在高溫下,Fe可與水蒸氣發生反應.應用下列裝置,試探究反應的部分產物.在硬質玻璃管Ⅰ中放入還原鐵粉和石棉絨的混合物,硬質玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛裝的物質是無水硫酸銅和石棉絨的混合物
在常溫下,Fe與水并不起反應,但在高溫下,Fe可與水蒸氣發生反應.應用下列裝置,試探究反應的部分產物.在硬質玻璃管Ⅰ中放入還原鐵粉和石棉絨的混合物,硬質玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛裝的物質是無水硫酸銅和石棉絨的混合物查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
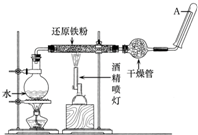 在常溫下,Fe與水并不起反應,但在高溫下,Fe與水蒸氣可發生反應.應用下列裝置,在硬質玻璃管中放入還原鐵粉和石棉絨的混合物,加熱,并通入水蒸氣,就可以完成高溫下“Fe與水蒸氣反應的實驗”.
在常溫下,Fe與水并不起反應,但在高溫下,Fe與水蒸氣可發生反應.應用下列裝置,在硬質玻璃管中放入還原鐵粉和石棉絨的混合物,加熱,并通入水蒸氣,就可以完成高溫下“Fe與水蒸氣反應的實驗”.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
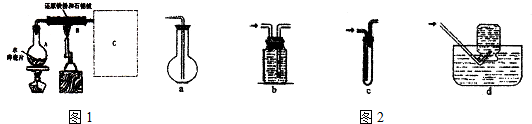
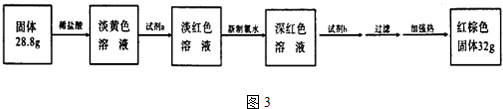
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
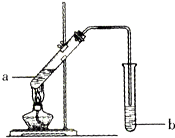 如圖為實驗室制備乙酸乙醋的裝置.
如圖為實驗室制備乙酸乙醋的裝置.| 物質 | 熔點/℃ | 沸點/℃ | 密度/g•cm-3 |
| 乙醇 | -114 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 濃H2SO4 | 338 | 1.84 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(CO)=1.2 mol/(L•s) | B. | v(NO2)=0.3 mol/(L•min) | ||
| C. | v(N2)=0.6 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com