


| 溫度/℃ | 1000 | 1115 | 1300 |
| 平衡常數 | 4.0 | 3.7 | 3.5 |
分析 (1)N2、CO、CO2、H2O中的電子數分別為14、14、22和10個;
(2)根據蓋斯定律來分析;
(3)①吸收CO后的溶液經過適當處理又可以重新生成醋酸亞銅氨,平衡逆向進行,結合平衡移動原理分析;
②CO吸附劑的開發大多數以銅(+1)為活性組分負載在各種載體上,然后采用變壓吸附(PSA)方式在含N2體系中脫出CO,圖象方向可知時間越長CO回收率越高;
(4)①溫度越高,該反應的平衡常數越小;
②a.適當降低反應體系的溫度,平衡右移;
b.及時移出體系中的CO2,平衡右移;
c.加入合適的催化劑,平衡不移動;
d.減小容器的容積,平衡不移動;
e.增大Fe2O3的量,平衡不移動.
解答 解:(1)N2、CO、CO2、H2O中的電子數分別為14、14、22和10個,故氮氣和CO為等電子體,故答案為:N2、CO;
(2)已知反應①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol
根據蓋斯定律可知,將①×2+②-③可得:CO(g)+2H2(g)=CH4(g)+$\frac{1}{2}$O2(g)△H=(-285.8kJ/mol)×2+(-283.0kJ/mol)-(-890.3kJ/mol)=+35.7KJ/mol,故答案為:+35.7;
(3)①CH3COOCu(NH3)2 (aq)+CO(g)?CH3COOCu(NH3)2•CO(aq)△H<0,反應是氣體體積減小的放熱反應,故升高溫度或減小壓強均可以使平衡左移從而實現CO與吸收液的分離,故答案為:升溫或減壓;
②CO吸附劑的開發大多數以銅(+1)為活性組分負載在各種載體上,然后采用變壓吸附(PSA)方式在含N2體系中脫出CO,圖象方向可知時間越長CO回收率越高,為了保證載銅吸附劑對CO的吸附和提純要求,應采取的措施是盡量在PSA-I中將CO2 脫除(保證PSA-I吸附CO2的時間);放空氣體”的主要成分為氮氣.
故答案為:盡量在PSA-I中將CO2 脫除(保證PSA-I吸附CO2的時間);氮氣;
(4)①溫度越高,該反應的平衡常數越小,故升高溫度,平衡左移,則反應放熱,即△H小于0,故答案為:<;
②a.適當降低反應體系的溫度,平衡右移,則CO的平衡轉化率提高,故a正確;
b.及時移出體系中的CO2,平衡右移,則CO的平衡轉化率提高,故b正確;
c.加入合適的催化劑,平衡不移動,CO的平衡轉化率不變,故c錯誤;
d.由于此反應是個氣體的物質的量不變的反應,故減小容器的容積,平衡不移動,CO的平衡轉化率不變,故d錯誤;
e.由于氧化鐵為固體,故增大Fe2O3的量,平衡不移動,則CO的平衡轉化率不變,故e錯誤.
故選ab.
點評 本題考查了平衡的移動和蓋斯定律的有關應用,綜合性較強,難度適中,應注意的是催化劑只能加快反應速率,不能使平衡發生移動,故不能提高物質的轉化率.


科目:高中化學 來源: 題型:選擇題
| A. | NH4+、OH-、Al3+、Cl- | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | Mg2+、NO3-、Cl-、Na+ | D. | MnO4-、K+、SO42-、Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 放電時,負極反應為:Zn+4OH--2e-=Zn(OH)42- | |
| B. | 充電時,電解質溶液中K+向陽極移動 | |
| C. | 充電時,電解質溶液中c(OH-)逐漸減小 | |
| D. | 放電時,電路中通過2mol電子,消耗氧氣22.4L(標準狀況) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在沸水中滴入含0.1molFeC13的飽和溶液,制得膠粒數為0.1 NA | |
| B. | 含0.4mol HNO3的稀硝酸與足量Fe反應,轉移電子數為1.2 NA | |
| C. | 120 gNaHSO4和MgSO4的晶體混合物中陽離子數為NA | |
| D. | 標準狀況下,44.8LSO2與足量O2反應生成的SO3分子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
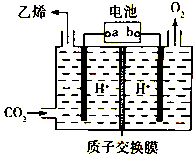 CO2是重要的溫室氣體,對地球溫室效應的“貢獻”最大,如何利用CO2是擺在科技工作者面前的重要課題.如圖所示電解裝置可將CO2轉化為乙烯,該裝置的電解質溶液為強酸性水溶液,電極材料為惰性電極.下列有關說法正確的是( )
CO2是重要的溫室氣體,對地球溫室效應的“貢獻”最大,如何利用CO2是擺在科技工作者面前的重要課題.如圖所示電解裝置可將CO2轉化為乙烯,該裝置的電解質溶液為強酸性水溶液,電極材料為惰性電極.下列有關說法正確的是( )| A. | a為電池的正極 | |
| B. | 電解過程中H+移向陽極 | |
| C. | 反應前后溶液的pH保持不變 | |
| D. | 陰極反應式:2CO2+12H++12e-=C2H4+4H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 充電時陽極反應式為:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 0.1molK2FeO4發生反應,轉移電子數約為1.806×1024 | |
| C. | 充電時K2FeO4發生氧化反應 | |
| D. | 放電時正極反應為:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 以Na2O2作供氧劑時,發生了氧化還原反應 | |
| B. | 在食品袋中放人CaCl2•6H2O,可防止食物受潮 | |
| C. | 人工合成食品級酯可以用作糖果的香料 | |
| D. | 用NH4Cl濃溶液除鐵銹,因為NH4 Cl水解顯酸性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只生成AgBr及AgI兩種沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol/L | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol/L | D. | 溶液中c(Ag+)≈3.2×10-8mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 操 作 | 現 象 | 解釋、結論 |
| A | 把過量的Fe粉中加入硝酸中充分反應,滴入KSCN溶液 | 溶液呈紅色 | 稀硝酸將Fe氧化為Fe3+ |
| B | 向飽和Na2CO3溶液中通入足量CO2 | 溶液變渾濁 | 析出了Na2CO3晶體 |
| C | 定容時不小心加水超過容量瓶的刻度線,立即用滴管吸去多余的部分 | 液體凹液面與刻度線相平 | 配制溶液的濃度不受影響 |
| D | 用玻璃棒蘸取濃氨水點到紅色石蕊試紙上 | 試紙變藍色 | 濃氨水呈堿性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com