
分析 (1)①氯化氫為強電解質,完全電離0.1mol•L-1的鹽酸氫離子濃度為0.1mol•L-1;②硫酸為強電解質,0.2mol•L-1的硫酸,氫離子濃度為 0.4mol•L-1; ③醋酸為弱電解質,部分電離,0.1mol•L-1的醋酸氫離子濃度小于0.1mol•L-1;④一水合氨為弱電解質,部分電離,0.1mol•L-1的氨水氫氧根離子濃度小于0.1mol•L-1; ⑤氫氧化鈉為強電解質,完全電離,0.1mol•L-1的NaOH溶液中氫氧根離子濃度0.1mol•L-1 ⑥氫氧化鋇為強電解質,完全電離,0.1mol•L-1的Ba(OH)2溶液,氫氧根離子濃度為0.2mol•L-1;
(2)電解質是指:在水溶液中或熔融狀態下能夠導電的化合物.電解質水溶液中或熔融狀態下能夠導電,是因電解質自身可以離解成自由移動的離子;
非電解質是指:在水溶液里和熔融狀態下都不導電的化合物;單質、混合物既不是電解質也不是非電解質;
強電解質是在水溶液中或熔融狀態下能完全電離的電解質,包括強酸、強堿、活潑金屬氧化物和大部分鹽;
(3)加水稀釋弱酸時,會促進弱酸的電離;依據中和反應中消耗的氫離子的物質的量等于氫氧根離子的物質的量解答;
(4)設出酸溶液的pH為a,堿溶液的pH為b,根據該溫度以及體積關系列式計算.
解答 解:(1))①氯化氫為強電解質,完全電離0.1mol•L-1的鹽酸氫離子濃度為0.1mol•L-1;②硫酸為強電解質0.2mol•L-1的硫酸,氫離子濃度為 0.4mol•L-1; ③醋酸為弱電解質,部分電離,0.1mol•L-1的醋酸氫離子濃度小于0.1mol•L-1;④一水合氨為弱電解質,部分電離,0.1mol•L-1的氨水氫氧根離子濃度小于0.1mol•L-1; ⑤氫氧化鈉為強電解質,完全電離,0.1mol•L-1的NaOH溶液中氫氧根離子濃度0.1mol•L-1 ⑥氫氧化鋇為強電解質,完全電離,0.1mol•L-1的Ba(OH)2溶液,氫氧根離子濃度為0.2mol•L-1;氫離子濃度越大,pH越小,氫氧根離子濃度越大,pH越大,所以pH由小到大的順序:②①③④⑤⑥;故答案為:②①③④⑤⑥;
(2)①NaCl是鹽,熔融狀態或者溶于水能夠完全電離,屬于強電解質; ②BaSO4是鹽熔融狀態能夠完全電離,屬于強電解質;
③H2SO4是強酸,溶于水能夠完全電離,屬于強電解質;④KOH是強堿,溶于水或者熔融狀態能完全電離屬于強電解質;
⑤石墨是單質既不是電解質,也不是非電解質; ⑥H2CO3是弱酸水溶液中能部分電離,屬于弱電解質;
⑦CH3COOH 是弱酸水溶液中能部分電離,屬于弱電解質;⑧NH3•H2O 是弱堿,水溶液中能部分電離,屬于弱電解質; ⑨蔗糖在水溶液和熔融狀態都不導電,屬于非電解質; ⑩酒精在水溶液和熔融狀態都不導電,屬于非電解質;⑪SO2本身不能電離,屬于非電解質;⑫Cu 單質,既不是電解質也不是非電解質;⑬Cl2 是單質既不是電解質,也不是非電解質;⑭CO2,本身不能電離,屬于非電解質;
屬于強電解質的有:①②③④;中屬于弱電解質的有:⑥⑦⑧;其中屬于非電解質的有⑨⑩⑪⑭;故答案為:①②③④;⑥⑦⑧;⑨⑩⑪⑭;
(3)某一元弱酸溶液(A)與二元強酸(B)的pH相等,則弱酸有大部分為電離,加水稀釋時,能夠促進更多的弱酸電離,所以加水稀釋后,氫離子濃度大于二元強酸中氫離子濃度,所以pHA<pHB,上述稀釋溶液中弱酸的氫離子的物質的量濃度大于強酸,所以等體積含有的氫離子的物質的量多,中和等濃度等體積的NaOH溶液,用的體積少;
故答案為:<;<;
(4)設強酸溶液的pH為a,體積為V,pH=-lgc(H+),溶液中氫離子濃度為:10-amol/L;堿溶液的pH為b,體積為10V,溶液中氫氧根離子的濃度為:c(OH-)=10-(14-b)mol/L,混合后溶液呈中性,則滿足溶液中氫離子的物質的量大于氫氧根離子的物質的量,即10-amol/L×VL=10-(14-b)mol/L×10VL,
解得:-a=b-13,a+b=13,即pH酸+pH堿=13,故答案為:pH酸+pH堿=13.
點評 本題考查了離子濃度大小的比較,電解質、強電解質、非電解質的判斷,溶液酸堿性與pH值的相關計算,題目綜合性強,涉及內容多,難度中等,解題時注意把握電解質強弱的判斷依據,注意弱電解質電離的特點.


 新課標快樂提優暑假作業陜西旅游出版社系列答案
新課標快樂提優暑假作業陜西旅游出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 纖維素、蛋白質都是有機高分子化合物 | |
| B. | 苯、甲苯等是煤的主要成分 | |
| C. | 花生油、牛油都是酯類 | |
| D. | 豆漿、牛奶可作為誤食重金屬鹽的解毒劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過氧化鈉的電子式: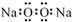 | |
| B. | “玉兔”號月球車上使用的質子數94,中子數144的钚原子:${\;}_{94}^{144}$Pu | |
| C. | CH4的球棍模型: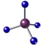 | |
| D. | Na的原子結構示意圖: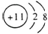 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | (1)中紅綜色變深,(2)中紅棕色變淺 | B. | (1)中紅綜色變淺,(2)中紅棕色變深 | ||
| C. | 燒瓶(1)中氣體的壓強不變 | D. | 燒瓶(2)中氣體的壓強增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 反應 | 大氣固氮 N2(g)+O2(g)?2NO(g) | |
| 溫度/℃ | 27 | 2000 |
| K | 3.84×10-31 | 0.1 |
| 容器 編號 | 起始時各物質物質的量/mol | 達平衡時體系的 能量變化 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 放熱23.1kJ |
| b | 0.6 | 1.8 | 0.8 | 吸熱Q kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 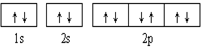 可表示單核10電子粒子基態時電子排布 可表示單核10電子粒子基態時電子排布 | |
| B. | 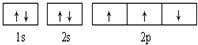 此圖錯誤,違背了泡利原理 此圖錯誤,違背了泡利原理 | |
| C. | 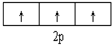 表示基態N原子的價電子排布 表示基態N原子的價電子排布 | |
| D. |  表示處于激發態的B的電子排布圖 表示處于激發態的B的電子排布圖 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 高中化學教材介紹了鈉、鎂、鋁、鐵、氯、硫、氮、硅等元素及其化合物的知識,是學習研究其它化學知識的載體.
高中化學教材介紹了鈉、鎂、鋁、鐵、氯、硫、氮、硅等元素及其化合物的知識,是學習研究其它化學知識的載體.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | Fe(OH)3溶液氫碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 銅溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | Na2S2O3溶液中通入足量氯氣:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com