
【題目】(1)某小組擬用酸性KMnO4溶液與H2C2O4溶液的反應(此反應為放熱反應)來探究“條件對化學反應速率的影響,并設計了如下的方案記錄實驗結果(忽略溶液混合體積變化)。
限選試劑和儀器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、MnSO4、蒸餾水、試管、量筒、秒表、恒溫水浴槽。
物理量 編號 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸餾水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列問題:
①寫出上述反應的離子方程式:________________________。
②上述實驗①②是探究____________對化學反應速率的影響;上述實驗②④是探究____________對化學反應速率
影響。若上述實驗②③是探究濃度對化學反應速率的影響,則a為______________;表格中的“乙”填寫t/s,其測量的是______________________。
③實驗①中對“乙”重復測量三次,所得數值分別13.6,13.5,13.4。忽略混合前后溶液體積的微小變化,這段時間內平均反應速率v(KMnO4)=___________ 。
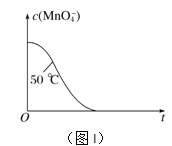
④已知實驗①50℃時c(MnO![]() )~反應時間t的變化曲線如圖I。若保持其他條件不變,請在坐標圖中,畫出實驗②25℃時c(MnO
)~反應時間t的變化曲線如圖I。若保持其他條件不變,請在坐標圖中,畫出實驗②25℃時c(MnO![]() )~t的變化曲線示意圖。______________
)~t的變化曲線示意圖。______________
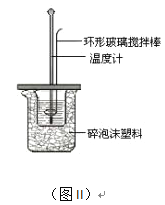
(2)測定中和熱的實驗裝置如圖II所示。
①寫出稀硫酸和稀氫氧化鈉溶液反應表示中和熱的熱化學方程式_______________________(中和熱數值為57.3 kJ/mol):
②取60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液進行實驗,實驗數據如下表。
實驗次數 | 起始溫度t1/℃ | 終止溫度 t2/℃ | 溫度差 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.9 | |
2 | 26.2 | 26.4 | 26.3 | 30.6 | |
3 | 25.9 | 25.9 | 25.9 | 29.5 | |
4 | 26.4 | 26.2 | 26.3 | 30.0 | |
近似認為0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比熱容c=4.18 J/(g·℃)。則中和熱△H=________________________kJ/mol(列出計算式)。
③能引起中和熱偏高的原因是(填字母)__________。
A.實驗裝置保溫、隔熱效果差
B.量取NaOH溶液的體積時仰視讀數
C.用50mL0.50mol/L醋酸代替了硫酸進行反應,
D.用溫度計測定NaOH溶液起始溫度后直接測定H2SO4溶液的溫度
E. 量取硫酸溶液的體積時仰視讀數
【答案】 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 溫度 催化劑 0.5 溶液褪色所需時間 5.0×10-4 mol·L-1·s-1 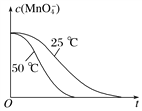 1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol 或H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l) △H=-114.6kJ/mol
1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol 或H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l) △H=-114.6kJ/mol  A
A
【解析】試題分析:(1)MnO4-被H2C2O4還原為Mn2+,H2C2O4被氧化為CO2氣體;②實驗①②的變量是溫度;實驗④比實驗②多加0.1g催化劑 MnSO4;實驗②③是探究H2C2O4溶液濃度對化學反應速率的影響,應控制KMnO4的濃度相同;要計算反應速率,需測量高錳酸鉀溶液褪色所需時間;③根據![]() 計算v(KMnO4);④實驗②的反應溫度比實驗①低,所以反應速率慢,褪色消耗時間多;(2)①中和熱是生成1mol水放出的熱量;②第2次實驗數據明顯偏離正常的誤差范圍,根據1、3、4三次實驗數據計算平均溫度差,根據Q=mc△T計算60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液反應放出的熱量;③中和熱是強酸和強堿反應生成1mol水時放出的熱量,依據Q=Q=mc△T來逐項分析。
計算v(KMnO4);④實驗②的反應溫度比實驗①低,所以反應速率慢,褪色消耗時間多;(2)①中和熱是生成1mol水放出的熱量;②第2次實驗數據明顯偏離正常的誤差范圍,根據1、3、4三次實驗數據計算平均溫度差,根據Q=mc△T計算60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液反應放出的熱量;③中和熱是強酸和強堿反應生成1mol水時放出的熱量,依據Q=Q=mc△T來逐項分析。
解析:(1)MnO4-被H2C2O4還原為Mn2+,H2C2O4被氧化為CO2氣體,反應的離子方程式是2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;②實驗①②的變量是溫度,所以實驗①②是探究溫度對化學反應速率的影響;實驗④比實驗②多加0.1g催化劑 MnSO4,所以實驗②④是探究催化劑對化學反應速率影響;實驗②③是探究H2C2O4溶液濃度對化學反應速率的影響,應控制KMnO4的濃度相同,所以需要加入0.5mL蒸餾水,故a=0.5;要計算反應速率,需測量高錳酸鉀溶液褪色所需時間;③三次實驗平均用時13.5s;④實驗②的反應溫度比實驗①低,所以反應速率慢,褪色消耗時間多,所以圖像是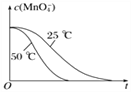 ;
;
(2)①中和熱是生成1mol水放出的熱量,稀硫酸和稀氫氧化鈉溶液反應表示中和熱的熱化學方程式是H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l) △H=-114.6kJ/mol;②第2次實驗明顯偏離正常的誤差范圍,根據1、3、4三次實驗數據,平均溫度升高3.7℃,根據Q=mc△T,60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液反應放出的熱量是(50+60)g![]() 4.18 J/(g·℃)
4.18 J/(g·℃) ![]() 3.7℃
3.7℃![]() kJ /J,60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液反應生成水的物質的量是0.06L
kJ /J,60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液反應生成水的物質的量是0.06L![]() 0.5mol/L,則△H=
0.5mol/L,則△H= 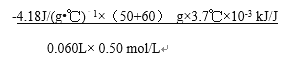 ;③A.實驗裝置保溫、隔熱效果差,測得中和熱偏小,故A錯誤;B.量取NaOH溶液的體積時仰視讀數,量取的氫氧化鈉偏多,生成水的物質的量多,所以放出熱量多,測得中和熱數值偏大,故B正確;
;③A.實驗裝置保溫、隔熱效果差,測得中和熱偏小,故A錯誤;B.量取NaOH溶液的體積時仰視讀數,量取的氫氧化鈉偏多,生成水的物質的量多,所以放出熱量多,測得中和熱數值偏大,故B正確;
C.用50mL0.50mol/L醋酸代替了硫酸進行反應,醋酸是弱酸,醋酸的電離是吸熱的過程,所以導致實驗測得中和熱的數值偏小,故C錯誤;D.用溫度計測定NaOH溶液起始溫度后直接測定H2SO4溶液的溫度,會發生酸和堿的中和,溫度計示數變化值減小,所以導致實驗測得中和熱的數值偏小,故D錯誤。E.由于硫酸本身就過量,量硫酸溶液的體積時仰視讀數,生成水的物質的量不變,放熱不變,實驗測得中和熱的數值無影響,故E錯誤。


科目:高中化學 來源: 題型:
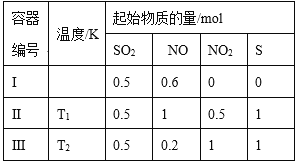
【題目】在3個體積均為1 L的恒容密閉容器中發生反應:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改變容器I的反應溫度,平衡時c( NO2)與溫度的關系如下圖所示。下列說法正確的是
2NO2(g)+S(s)。改變容器I的反應溫度,平衡時c( NO2)與溫度的關系如下圖所示。下列說法正確的是
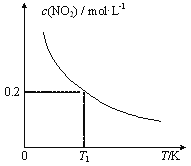
A. 該反應的ΔH<0
B. T1時,該反應的平衡常數為![]()
C. 容器Ⅰ與容器Ⅱ均在T1時達到平衡,總壓強之比小于1:2
D. 若T2<T1,達到平衡時,容器Ⅲ中NO的體積分數小于40%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生做如下實驗:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即變藍;第二步,在上述藍色溶液中,滴加足量的Na2SO3溶液,藍色逐漸消失。下列有關該同學對實驗原理的解釋和所得結論的敘述不正確的是( )
A. 氧化性:ClO->I2>SO42—
B. 藍色消失的原因是Na2SO3溶液具有漂白性
C. 淀粉KI溶液變藍是因為I-被ClO-氧化為I2,I2使淀粉變藍
D. 若將Na2SO3溶液加入氯水中,氯水褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組利用BaS的還原性提純HBr溶液,并制取溴化鎂的方案如下:
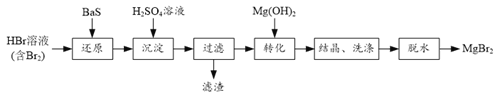
(1) “還原”步驟中BaS不宜過量太多的原因是______。
(2)濾渣的成分是______。
(3)結晶獲得的MgBr2·6H2O用乙醇洗滌,從洗滌液中回收乙醇的實驗方法是______。
(4)利用如圖裝置將MgBr2·6H2O脫水得到MgBr2。
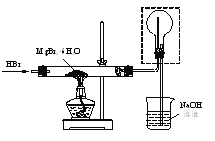
①通入HBr的目的是______。
②圖中框內裝置的作用是______。
(5)已知:BaS+H2O2=Ba(OH)2+S↓。請補充完整實驗室由BaS制取高純BaSO3的實驗方案:取BaS加水浸出,邊攪拌邊在浸出液中加入過量H2O2,過濾,______,(實驗中須使用的試劑有:SO2氣體,溶有SO2的水,除常用儀器外須使用的儀器有:真空干燥箱、pH計)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】厭氧氨化法(Anammox)是一種新型的氨氮去除技術,下列說法中不正確的是

A. 1mol NH4+ 所含的質子總數為10NA
B. 聯氨(N2H4)中含有極性鍵和非極性鍵
C. 過程II屬于氧化反應,過程IV屬于還原反應
D. 過程I中,參與反應的NH4+與NH2OH的物質的量之比為1:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關能量轉化的認識不正確的是( )
A.通過植物的光合作用,太陽能轉化為化學能
B.人類使用照明設備,將電能轉化為光能
C.生物體內的化學變化過程,在能量轉化上比在體外發生的一些能量轉化更為合理有效
D.燃料燃燒,只是將化學能轉化為熱能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知某反應A(g)+B(g)![]() C(g)+D(g)過程中的能量變化如圖所示,回答問題。
C(g)+D(g)過程中的能量變化如圖所示,回答問題。
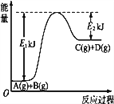
該反應是____(填“吸熱”或“放熱”)反應,該反應的ΔH=_____ kJ· mol-1(用含E1、E2的代數式表示)。
(2)已知在常溫常壓下:
①2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l) =H2O(g) ΔH=+44.0 kJ·mol-1
寫出表示甲醇燃燒熱的熱化學方程式___________________________。
(3)已知:H2(g)+Cl2(g)==2HCl(g) ΔH=-185 kJ/mol,斷裂1 mol H—H鍵吸收的能量為436 kJ,斷裂1 mol Cl—Cl鍵吸收的能量為247 kJ,則形成1 mol H—Cl鍵放出的能量為______kJ。
(4)FeS2焙燒產生的SO2可用于制硫酸。已知25 ℃、101 kPa時:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
則SO3(g)與H2O(l)反應生成H2SO4(l)的熱化學方程式是_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖表示AE五種物質間的相互轉化關系,其中A為淡黃色固體,B為單質。試推出各物質的化學式,并寫出B→C、C→D、D→E反應的化學方程式。
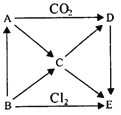
(1)寫出B→C、C→D、D→E反應的化學方程式:
B→C:_______________;
C→D:_______________;
D→E:_______________;
(2)將3.9 gA投入到足量的水中充分反應,生成的氣體在標準狀況下的體積為_____L,將反應后的溶液配成1000mL溶液,所得溶液的物質的避濃度為______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com