
【題目】一種含鋁、鋰、鈷的新型電子材料,生產中產生的廢料數量可觀,廢料中的鋁以金屬鋁箔的形式存在;鈷以Co2O3·CoO的形式存在,吸附在鋁箔的單面或雙面;鋰混雜于其中。從廢料中制取高純碳酸鈷(CoCO3)的工藝流程如圖:
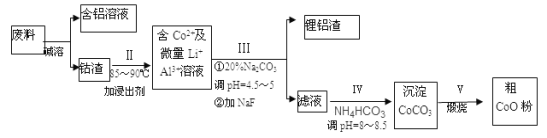
(1)寫出一條加快堿溶速率的措施__。
(2)過程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出鈷。則浸出鈷的離子反應方程式為__(產物中只有一種酸根)。該過程不能用鹽酸代替硫酸進行酸化,原因是_。
(3)過程Ⅲ中碳酸鈉溶液的作用是沉淀Al3+和Li+,寫出沉淀Al3+的離子方程式__。
(4)過程Ⅳ沉鈷的離子方程式是__。
(5)CoCO3可用于制備鋰離子電池的正極材料LiCoO2,其生產工藝是將n(Li):n(Co)=l:l的Li2CO3和CoCO3的固體混合物在空氣中加熱至700℃~900℃。試寫出該反應的化學方程式__。
【答案】廢料粉碎、升高溫度、增大堿液的濃度。 4Co2O3·CoO + S2O32-+ 22H+= 12Co2++ 2SO42-+ 11H2O Co2O3·CoO可氧化鹽酸產生Cl2,污染環境 2Al3++3CO32-+3H2O = 2Al(OH)3↓+3CO2↑ Co2++2HCO3-= CoCO3↓+CO2↑+H2O 2Li2CO3+4CoCO3+O2![]() 4LiCoO2+ 6CO2↑
4LiCoO2+ 6CO2↑
【解析】
(1)根據影響反應速率的因素回答加快堿溶速率的措施;
(2)過程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液,Co3+被還原為Co2+, S2O32-被氧化為SO42-;Co3+具有強氧化性,能把鹽酸氧化為氯氣;
(3)過程Ⅲ中碳酸根離子與Al3+發生雙水解反應生成氫氧化鋁沉淀和二氧化碳氣體;
(4)過程Ⅳ沉鈷是Co2+與HCO3-反應生成CoCO3沉淀和二氧化碳氣體;
(5)將n(Li):n(Co)=l:l的Li2CO3和CoCO3的固體混合物在空氣中加熱至700℃~900℃生成LiCoO2,氧氣把Co(Ⅱ)氧化為Co(Ⅲ),根據電子守恒配平方程式。
(1)根據影響反應速率的因素,廢料粉碎、升高溫度、增大堿液的濃度都可以加快堿溶速率;
(2)過程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液,Co(Ⅲ)被還原為Co(Ⅱ), S2O32-被氧化為SO42-,浸出鈷的離子反應方程式為4Co2O3·CoO + S2O3 2-+ 22H+= 12Co2++ 2SO42- + 11H2O。Co2O3·CoO具有強氧化性,能把鹽酸氧化為Cl2,污染環境,所以不能用鹽酸代替硫酸進行酸化;
(3)過程Ⅲ中碳酸根離子與Al3+發生雙水解反應生成氫氧化鋁沉淀和二氧化碳氣體,沉淀Al3+的離子方程式是2Al3++3CO32-+3H2O = 2Al(OH)3↓+3CO2↑;
(4)過程Ⅳ沉鈷是Co2+與HCO3-反應生成CoCO3沉淀和二氧化碳氣體,反應的離子方程式是Co2++2HCO3-= CoCO3↓+CO2↑+H2O;
(5)將n(Li):n(Co)=l:l的Li2CO3和CoCO3的固體混合物在空氣中加熱至700℃~900℃生成LiCoO2,氧氣把Co(Ⅱ)氧化為Co(Ⅲ),根據電子守恒配平方程式為2Li2CO3+4CoCO3+O2![]() 4LiCoO2+ 6CO2↑。
4LiCoO2+ 6CO2↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】二甲醚是一種重要的清潔燃料,可替代氟氯代烷作制冷劑,利用水煤氣合成二甲醚的三步反應如下:
2H2(g)+CO(g)=CH3OH(g) ΔH=-90.8 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1
請回答下列問題。
(1)由 H2和CO直接制備二甲醚的總反應:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的ΔH=________。一定條件下的密閉容器中,該總反應達到平衡,要提高CO的平衡轉化率,可以采取的措施有________(填字母代號)。
a.高溫高壓 b.加入催化劑 c.分離出CO2
d.增加CO的量 e.分離出二甲醚
(2)某溫度下反應2CH3OH(g)![]() CH3OCH3(g)+H2O(g)的平衡常數為400。此溫度下,在密閉容器中加入CH3OH,反應到某時刻測得各組分的濃度如下:
CH3OCH3(g)+H2O(g)的平衡常數為400。此溫度下,在密閉容器中加入CH3OH,反應到某時刻測得各組分的濃度如下:
物質 | CH3OH | CH3OCH3 | H2O |
濃度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比較此時正、逆反應速率的大小:v正___(填“>”“<”或“=”)v逆。
②若加入CH3OH后,經10 min反應達到平衡,此時c(CH3OH)=________,該時間段內v(CH3OH)=________。
(3)有研究者在催化劑(含Cu—Zn—Al—O和Al2O3)、壓強為5.0 MPa的條件下,在相同時間內測得CH3OCH3產率隨溫度變化的曲線如圖甲所示。其中CH3OCH3產率隨溫度升高而降低的原因可能是_____________________________________。

(4)二甲醚直接燃料電池具有啟動快、效率高、能量密度高等優點,可用于電化學降解治理水中硝酸鹽的污染。電化學降解NO3-的原理如圖乙所示。若電解質為酸性,二甲醚直接燃料電池的負極反應式為____________________;若電解過程中轉移了2 mol電子,則陽極室減少的質量為_________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、Z、R、T的原子半徑與原子序數關系如下圖所示。Y與Z能形成Z2Y、Z2Y2型離子化合物,R原子最外層電子數是電子層數的2倍,T單質但難溶于水微溶于酒精。下列說法正確的是

A. 最高價氧化物對應水化物的酸性:R>T
B. 氫化物的沸點一定是Y>R
C. 原子半徑和離子半徑均滿足Y<Z
D. 由X、Y、Z、T四種元素組成的化合物中既含有離子鍵又含有共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是化學課外活動小組設計的用化學電源(鋅銅硫酸原電池)使LED燈發光的裝置示意圖。下列有關該裝置的說法正確的是( )

A.銅片為負極B.鋅片上發生還原反應
C.其能量轉化的形式主要是“化學能→電能→光能”D.如果將稀硫酸換成鹽酸,LED燈將不會發光
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.某實驗小組對H2O2的分解做了如下探究,將質量相同的粉末狀和塊狀的MnO2分別加入盛有15 mL5%的H2O2溶液的大試管中,并用帶火星的木條測試,下表是該實驗小組研究影響H2O2分解速率的因素時記錄的一組數據。
MnO2 | 觸摸試管情況 | 觀察結果 | 反應完成所需的時間 |
粉末狀 | 很燙 | 劇烈反應,帶火星的木條復燃 | 3.5 min |
塊狀 | 微熱 | 反應較慢,火星紅亮但木條未復燃 | 30 min |
(1)寫出大試管中發生反應的化學方程式:______。該反應是______(填“放熱”或“吸熱”)反應。
(2)實驗結果表明,催化劑的催化效果與____有關。
(3)某同學在10 mLH2O2溶液中加入一定量的MnO2,放出氣體的體積(標準狀況)與反應時間的關系如下圖所示,則A、B、C三點所表示的反應速率最慢的是____。

Ⅱ.某反應在體積為5 L的恒容密閉容器中進行,在0~3分鐘內各物質的量的變化情況如下圖所示(A,B,C均為氣體)。

(4)該反應的化學方程式為____。
(5)反應開始至2分鐘時,B的平均反應速率為_____,A的轉化率為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近意大利羅馬大學的FuNvio Cacace等人獲得了極具理論研究意義的N4分子。N4分子結構如圖所示,已知斷裂1 mol N-N吸收193 kJ熱量,生成1 mol N≡N放出941 kJ熱量。根據以上信息和數據,下列說法正確的是( )

A. N4屬于一種新型的化合物
B. N4是N2的同位素
C. N4轉變為N2是物理變化
D. 1 mol N4氣體轉變為N2放出724 kJ能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某氣態烴A在標準狀況下的密度為1.25g/L,其產量可以用來衡量一個國家的石油化工發展水平。B和D都是生活中常見的有機物,D能跟碳酸氫鈉反應。它們之間的轉化關系如下圖所示:

(1)A的結構式為___; F的結構簡式為___;D中官能團的名稱為___。
(2)反應①的反應類型是____,反應③的化學方程式為________。
(3)反應②在Cu做催化劑的條件下進行,該實驗的步驟是將紅亮的銅絲置于酒精燈上加熱,待銅絲變為黑色時,迅速將其插入到裝有B的試管中 (如圖所示)。

重復操作2-3次,觀察到的現象是___,該反應的化學方程式為______。
(4)B和D在濃硫酸的作用下實現反應④,實驗裝置如下圖所示:

實驗開始前飽和X溶液的溶質是_________;
飽和X溶液的作用是:___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A是一種常見金屬,F是一種紅褐色沉淀。試根據圖中轉化關系,回答下列問題。

(1)寫出F、G的化學式。F:__,G:___。
(2)檢驗D中陽離子的方法___。
(3)保存C溶液時為什么要加固體A__。
(4)寫出下列轉化的離子方程式或化學方程式。
①A→C:___。
②C→D:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化亞硝酰(NOCl,沸點為-5.5℃)是有機合成中的重要試劑,為黃色氣體,具有刺鼻惡臭味,遇水反應,有多種方法制備氯化亞硝酰。已知:HNO2既有氧化性又有還原性,AgNO2微溶于水,溶于硝酸:AgNO2+HNO3=AgNO3+HNO2。
(1)將5g在300℃下干燥了3h并研細的KCl粉末裝入50mL帶有接頭及抽真空用活塞的玻璃容器內。將容器盡量減壓,在減壓條件下通入0.002molNO2。反應12~36min即可完成,紅棕色的NO2消失,出現黃色的氯化亞硝酰,同時還得到一種鹽,該鹽的化學式為_。氯化鉀需要“干燥”的原因是__。
(2)實驗室可由氯氣與一氧化氮在常溫常壓下合成氯化亞硝酰,裝置如圖所示。

①儀器a的名稱為__。
②干燥管中盛放的試劑為_。
③生成NOCl的化學方程式為__。
(3)為驗證NOCl與H2O反應后的溶液中存在Cl-和HNO2,設計如下實驗步驟,完成下列表格。
步驟 | 實驗現象或反應的化學方程式 |
①取5mL儀器a中產品,加入盛有水的燒杯中,充分反應 | NOCl與H2O反應的化學方程式為__ |
②向燒杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,實驗現象為__ |
③向步驟②燒杯中滴加酸性KMnO4溶液 | 實驗現象為_ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com