
| A. | 除去FeSO4溶液中的CuSO4可加入適量鐵粉,再過濾 | |
| B. | 通過灼熱的CuO除去H2中的CO | |
| C. | 除去NaCl中少量的Na2SO4可依次加入BaCl2、Na2CO3、HCl溶液 | |
| D. | 除去溴苯中的溴,可用NaOH溶液洗滌,再分液 |
分析 A.Fe與硫酸銅反應生成硫酸亞鐵和Cu;
B.氫氣、CO均可還原CuO;
C.氯化鋇與硫酸鈉反應生成硫酸鋇沉淀,過量的氯化鋇利用碳酸鈉除去,過量的碳酸鈉利用鹽酸除去;
D.溴與NaOH溶液反應后,與溴苯分層.
解答 解:A.Fe與硫酸銅反應生成硫酸亞鐵和Cu,Fe、Cu不溶于水,然后過濾可除雜,故A正確;
B.氫氣、CO均可還原CuO,將原物質反應掉,不符合除雜的原則,故B錯誤;
C.氯化鋇與硫酸鈉反應生成硫酸鋇沉淀,過量的氯化鋇利用碳酸鈉除去,過量的碳酸鈉利用鹽酸除去,則除去NaCl中少量的Na2SO4可依次加入BaCl2、Na2CO3、HCl溶液,故C正確;
D.溴與NaOH溶液反應后,與溴苯分層,然后分液可除雜,故D正確;
故選B.
點評 本題考查混合物分離提純,為高頻考點,把握物質的性質、性質差異、發生的反應及混合物分離方法為解答的關鍵,側重分析與應用能力的考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 化學平衡常數反映了在一定溫度下可逆反應可能進行的限度 | |
| B. | 四種平衡常數都是溫度的函數,溫度升高其數值都增大 | |
| C. | 一個可逆反應的化學平衡常數和參與反應的每種物質的化學計量數都有關系 | |
| D. | 純水中加入強酸或強堿,水的離子積常數都會減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4HCO3 $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ | |
| B. | C+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| C. | 3Cl2+6NaOH═5NaCl+NaClO3+3H2O | |
| D. | 2HCl+CaCO3═CaCl2+CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 31g白磷中含有的共價鍵數目為1.5NA | |
| B. | 0.1L3.0mol•L-1的NH4N03溶液中含有的NH4+的數目為0.3NA | |
| C. | 標準狀況下,22.4L己烷中含共價鍵數目為19NA | |
| D. | 常溫常壓下,lmolCl2與足量的水充分反應,轉移的電子數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
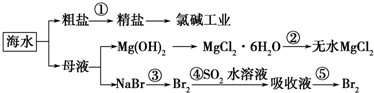
| A. | 除去粗鹽中雜質(Mg2+、SO42-、Ca2+),加入的藥品順序為:NaOH溶液→Na2CO3溶液→BaCl2溶液→過濾后加鹽酸 | |
| B. | 在過程②中將MgCl2•6H2O灼燒即可制得無水MgCl2 | |
| C. | 從能量轉換角度來看,氯堿工業中的電解飽和食鹽水是一個將化學能轉化為電能的過程 | |
| D. | 從第③步到第⑤步的目的是為了濃縮 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿性溶液中:K+、Mg2+、S2-、ClO- | |
| B. | 室溫下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入鋁粉有氣泡產生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 在AlCl3溶液中:K+、Na+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
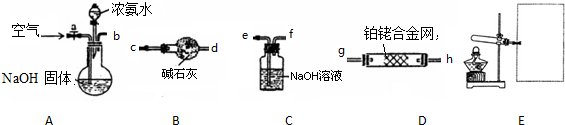
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 右;( M+2Q) | B. | 右;(M+4Q ) | C. | 左;(M+2Q) | D. | 左;(M+4Q) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com