
 |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
| 8-x+11-0.5x+x+81 |
| 100 |
| 7 |
| 8 |
| 7×7 |
| 1×1×7.5 |


科目:高中化學 來源: 題型:
| A、該電池替代現在電動車廣泛使用的鉛蓄電池可以減少重金屬的污染 |
| B、該電池放電時溶液中Li+的離子移向正極 |
| C、該電池的負極電極反應式為Al-3e-=Al3+ |
| D、充電時,陰極發生的電極反應式為Li2S+Fe-2e-=2Li++FeS |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、1.0L 1.0mo1?L-1的NaAlO2水溶液中含有的氧原子數為2NA |
| B、12g石墨烯(單層石墨)中含有六元環的個數為0.5NA |
| C、25℃時pH=13的NaOH溶液中含有OH-的數目為0.1NA |
| D、1mol的羥基與1moL的氫氧根離子所含電子數均為9NA |
查看答案和解析>>
科目:高中化學 來源: 題型:

| ||
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

查看答案和解析>>
科目:高中化學 來源: 題型:
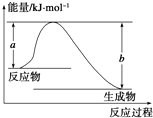 斷開1mol AB(g)分子中的化學鍵使其分別生成氣態A原子和氣態B原子所吸收的能量稱為A-B鍵的鍵能.下表列出了一些化學鍵的鍵能E:
斷開1mol AB(g)分子中的化學鍵使其分別生成氣態A原子和氣態B原子所吸收的能量稱為A-B鍵的鍵能.下表列出了一些化學鍵的鍵能E:| 化學鍵 | H-H | Cl-Cl | O═O | C-Cl | C-H | O-H | H-Cl |
| E/kJ?mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的鹽酸,邊加邊振蕩.使其充分反應,產生CO2氣體的體積(標準狀況)與所加鹽酸體積之間的關系如圖所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的鹽酸,邊加邊振蕩.使其充分反應,產生CO2氣體的體積(標準狀況)與所加鹽酸體積之間的關系如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:
 S2Cl2常用于橡膠硫化,有機物氯化的試劑,某研究性學習小組擬用實驗室常用試劑和儀器合成S2Cl2.
S2Cl2常用于橡膠硫化,有機物氯化的試劑,某研究性學習小組擬用實驗室常用試劑和儀器合成S2Cl2.查看答案和解析>>
科目:高中化學 來源: 題型:

| 溫度 | 平衡濃度/(mol L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
 電滲析法淡化海水示意圖如圖所示,其中陰(陽)離子交換膜僅允許陰(陽)離子通過.
電滲析法淡化海水示意圖如圖所示,其中陰(陽)離子交換膜僅允許陰(陽)離子通過.查看答案和解析>>
科目:高中化學 來源: 題型:
| A、18g D2O含有電子數為9NA |
| B、標準狀況下,11.2L乙酸中含有的分子數目為0.5NA |
| C、78g Na2O2中含有的離子總數為4NA |
| D、1L 1mol?L-1 Na2CO3溶液中,溶液中CO32-離子數是NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com