
 乙二酸俗稱草酸是一種二元弱酸(結構簡式為HOOC-COOH,可簡寫為H2C2O4),它是一種重要的化工原料.(常溫下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:
乙二酸俗稱草酸是一種二元弱酸(結構簡式為HOOC-COOH,可簡寫為H2C2O4),它是一種重要的化工原料.(常溫下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
分析 (1)常溫下0.01mol/L的H2C2O4pH為2.1,KHC2O4,的pH為3.1,說明草酸是二元弱酸;
(2)HC2O4-既能夠電離也能夠水解,KHC2O4溶液顯酸性,說明HC2O4-的電離程度大于水解程度;
A.根據物料守恒判斷;
B.根據電荷守恒判斷;
C.根據物料守恒、電荷守恒判斷;
D.若恰好反應,c(K+)=c(Na+),此時溶液呈堿性,故加入的氫氧化鈉的物質的量略少些;
(3)草酸和高錳酸鉀溶液反應在酸性溶液中 發生氧化還原反應,草酸被氧化為二氧化碳,高錳酸鉀被還原為錳離子;反應開始時速率較慢,隨后大大加快,說明生成的Mn2+對該反應具有催化作用;
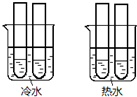
(4)兩燒杯中水的溫度不同,該實驗是研究溫度對反應速率的影響;草酸與高錳酸鉀反應的物質的量之比為5:2,據此分析.
解答 解:(1)二元弱酸分步電離,草酸電離方程式為:H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-,
故答案為:H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-;
(2)HC2O4-既能夠電離也能夠水解,KHC2O4溶液顯酸性,說明HC2O4-的電離程度大于水解程度;
A.碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根據物料守恒有c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),故A正確;
B.根據電荷守恒有:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),溶液呈中性,則c(H+)=c(OH-),故c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-),故B錯誤;
C.由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)、c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)可知,c(Na+)=c(C2O42-)-c(H2C2O4),故C錯誤;
D.若恰好反應,c(K+)=c(Na+),此時溶液呈堿性,故加入的氫氧化鈉的物質的量略少些,故c(K+)>c(Na+),故D正確;
故答案為:HC2O4-的電離程度大于水解程度;AD;
(3)草酸和高錳酸鉀溶液反應在酸性溶液中 發生氧化還原反應,草酸被氧化為二氧化碳,高錳酸鉀被還原為錳離子,反應的離子方程式為:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,反應開始時速率較慢,隨后大大加快,說明生成的Mn2+對該反應具有催化作用,
故答案為:2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O;反應生成的Mn2+對該反應具有催化作用;
(4)兩燒杯中水的溫度不同,該實驗是研究溫度對反應速率的影響;草酸與高錳酸鉀反應的物質的量之比為5:2,試管中草酸與高錳酸鉀物質的量之比為1:2,高錳酸鉀過量,不能完全反應,所以不褪色,
故答案為:溫度對反應速率的影響;KMnO4溶液過量.
點評 本題考查弱電解質的電離平衡及其應用,題目難度中等,涉及草酸的電離方程式書寫、電解質溶液中的電荷守恒和物料守恒、草酸的還原性以及影響化學反應速率的因素的探究,試題培養了學生的分析能力及靈活應用能力.


 快樂暑假暑假能力自測中西書局系列答案
快樂暑假暑假能力自測中西書局系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
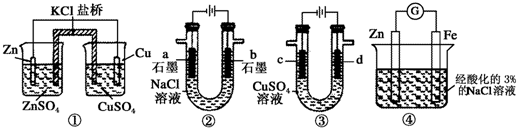
| A. | 裝置①中,一段時間后SO42-濃度增大 | |
| B. | 裝置②中滴入酚酞,a極附近變紅 | |
| C. | 用裝置③精煉銅時,c極為粗銅 | |
| D. | 裝置④中發生吸氧腐蝕 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度,氯化銨水解程度增大 | |
| B. | 水解平衡向右移動,溶液的pH一定減小 | |
| C. | 向溶液中加入氯化鈉固體,能抑制氯化銨的電離 | |
| D. | 向溶液中加入氯化銨固體,水解平衡向右移動,水解程度增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
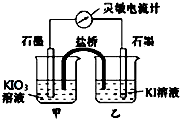 將反應IO3-+5I-+6H+?3I2+3H2O設計成如圖所示的原電池.
將反應IO3-+5I-+6H+?3I2+3H2O設計成如圖所示的原電池.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 共價化合物:是否含有共價鍵 | |
| B. | 氧化還原反應:元素化合價是否變化 | |
| C. | 強弱電解質:溶液的導電能力大小 | |
| D. | 溶液與膠體:本質不同的原因是能否發生丁達爾效應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
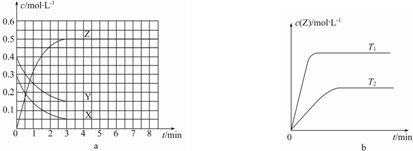
| A. | 該反應的正反應是放熱反應 | |
| B. | 若在第6 min時升高溫度,正反應速率增大,逆反應速率減小,平衡向正反應方向移動 | |
| C. | 圖a中反應達到平衡時,Y的轉化率為37.5% | |
| D. | 反應中某時刻各物質的正反應速率為2v(X)═2v(Y)═v(Z) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com