
 原電池是直接把化學能轉化為電能的裝置.
原電池是直接把化學能轉化為電能的裝置.分析 (1)Cu-Zn原電池中Zn在負極發生氧化反應,Zn失電子生成Zn2+;Cu為正極,正極上氫離子得電子,生成氫氣;
(2)根據反應“Cu+2FeCl3=CuCl2+2FeCl2”可知,反應中銅被氧化,應為原電池負極,因失電子而被氧化,正極應為活潑性比銅弱的金屬或導電的非金屬材料,Fe 3+在正極得到電子而被還原,電解質溶液應選發生還原反應的電解質,所以選氯化鐵溶液為電解質溶液.
解答 解:(1)Cu-Zn原電池中Zn在負極發生氧化反應,Zn失電子生成Zn2+,其電極反應為:Zn-2e-=Zn2+;Cu為正極,正極上氫離子得電子,生成氫氣,其電極反應為:2H++2e-=2H2↑;
故答案為:氧化;Zn-2e-=Zn2+;正;2H++2e-=2H2↑;
(2)反應“Cu+2FeCl3=CuCl2+2FeCl2”可知,反應中銅被氧化,應為原電池負極,失電子而被氧化,電極反應為Cu-2e-=Cu2+,正極應為活潑性比Cu弱的金屬或非金屬材料,Fe3+在正極得到電子而被還原,電極反應式為2Fe3++2e-=2Fe2+,電解質溶液為FeCl3.
故答案為: ;Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+.
;Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+.
點評 本題考查原電池的設計及原電池的工作原理,題目難度不大,注意:
1、從氧化還原反應的角度由電池反應判斷電極反應;
2、寫電極反應式要結合電解質溶液,如果電解質溶液不同,即使原料相同,電極反應式也不同,如氫氧燃料電池,當電解質為酸或堿,電極反應式不同.


 小學教材全測系列答案
小學教材全測系列答案 小學數學口算題卡脫口而出系列答案
小學數學口算題卡脫口而出系列答案 優秀生應用題卡口算天天練系列答案
優秀生應用題卡口算天天練系列答案 浙江之星課時優化作業系列答案
浙江之星課時優化作業系列答案科目:高中化學 來源: 題型:解答題
| 名稱 | 托盤天平(帶砝碼) | 小燒杯 | 坩堝鉗 | 玻璃棒 | 藥匙 | 量筒 |
| 儀器 |  |  |  |  |  |  |
| 序號 | a | b | c | d | e | f |
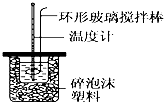
| 溫度 實驗次數 | 起始溫度t1/℃ | 終止溫 度t2/℃ | 平均溫度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 請填寫(4.0℃ ) |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子核外電子排布式為1s2的X原子與原子核外電子排布式為1s22s2的Y原子 | |
| B. | 原子核外M層上僅有兩個電子的X原子與原子核外N層上僅兩個電子的Y原子 | |
| C. | 2p軌道上只有一個空軌道的X原子與3p軌道上只有一個空軌道的Y原子 | |
| D. | 最外層都只有一個電子的X、Y原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H1>△H2>△H3 | B. | △H2<△H3<△H1 | C. | △H1=△H2=△H3 | D. | △H2>△H3>△H1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
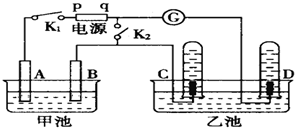
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 農藥由含磷的有機物發展成為對人畜毒性較低的含砷有機物等 | |
| B. | 在周期表中金屬與非金屬的分界處,可以找到半導體材料,如硅、鍺等 | |
| C. | 人們在過渡元素中尋找催化劑和耐高溫、耐腐蝕的合金材料 | |
| D. | 利用周期表中相鄰元素性質相似的規律,在周期表一定區域內尋找元素,發現物質的新用途被視為相當有效的方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com