
(1)蓋斯定律在生產和科學研究中有很重要的意義。有些反應的反應熱雖然無法直接測得,但可通過間接的方法測定。現根據下列3個熱化學反應方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.4kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
寫出CO氣體還原FeO固體得到Fe 固體和CO2氣體的熱化學反應方程式:
。
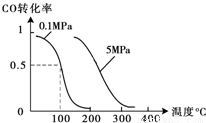
(2)在壓強為0.1 MPa條件下,容積為V L某密閉容器中a mol CO與 2a mol H2在催化劑作用下反應生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的轉化率與溫度、壓強的關系如圖所示。
CH3OH(g);CO的轉化率與溫度、壓強的關系如圖所示。
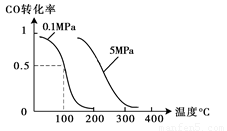
①該反應的△H 0 (填“<”、“>”或“=”)。
②在溫度容積不變的情況下,向該密閉容器再
增加a mol CO與 2a mol H2,達到新平衡時,CO的轉化率 (填“增大”、“減小”或“不變”)。
(3)實驗室中配制AgNO3溶液時通常需要向其中加入 ,目的是 ; AgCl在水中存在沉淀溶解平衡:
AgCl(s) Ag+(aq)+Cl-(aq)。25oC時,現將足量AgCl分別放入:①l00mL蒸餾水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化鎂溶液;④100mL 0.1 mol?L-1氯化鈉溶液。充分攪拌后,相同溫度下Ag+濃度由大到小的順序是 (填寫序號)。
Ag+(aq)+Cl-(aq)。25oC時,現將足量AgCl分別放入:①l00mL蒸餾水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化鎂溶液;④100mL 0.1 mol?L-1氯化鈉溶液。充分攪拌后,相同溫度下Ag+濃度由大到小的順序是 (填寫序號)。
(1)CO(g)+FeO(s)===Fe(s)+CO2(g) △H=-218.0kJ/mol
(2)① <; ② 增大(3)硝酸 抑制Ag+水解
②①④③
【解析】
試題分析:(1)CO氣體還原FeO固體得到Fe 固體和CO2氣體的熱化學反應方程式為CO(g)+FeO(s)===Fe(s)+CO2(g) △H的計算如下,將3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)加上Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) 乘以2,得到3Fe2O3(s)+ 3CO(g)=6FeO(s)+3CO2(g),化簡得到Fe2O3(s)+ CO(g)=2eO(s)+CO2(g),
△H=1/3(-47.4kJ·mol-1+2×+640.5)=411.2kJ·mol-1,將Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)減去Fe2O3(s)+ CO(g)=2FeO(s)+CO2(g),化簡得到2FeO(s)+2 CO(g)=2Fe(s)+2CO2(g) ,
△H=-24.8-411.2=-436kJ/mol,所以CO氣體還原FeO固體得到Fe 固體和CO2氣體的熱化學反應方程式為CO(g)+FeO(s)===Fe(s)+CO2(g) △H=-218.0kJ/mol;
(2)①由圖可以知道,溫度升高,CO的轉化率減小,所以該反應為放熱反應,故△H<0,②在溫度容積不變的情況下,向該密閉容器再增加a mol CO與 2a mol H2,達到新平衡時,相當于增大壓強,反應向正方向移動,所以CO的轉化率增大;
(3)由于銀離子易水解,所以配制AgNO3溶液時通常需要向其中加入硝酸,目的是抑制Ag+水解,AgCl(s) Ag+(aq)+Cl-(aq),在①l00mL蒸餾水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化鎂溶液;④100mL 0.1 mol?L-1氯化鈉溶液中,充分攪拌后,相同溫度下Ag+濃度由大到小的順序是②①④③。
Ag+(aq)+Cl-(aq),在①l00mL蒸餾水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化鎂溶液;④100mL 0.1 mol?L-1氯化鈉溶液中,充分攪拌后,相同溫度下Ag+濃度由大到小的順序是②①④③。
考點:熱化學方程式的書寫,化學平衡
點評:本題考查了熱化學方程式的書寫,化學平衡,第一小題的計算比較繁雜,后面兩個小題比較容易。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
 (1)蓋斯定律在生產和科學研究中有很重要的意義.有些反應的反應熱雖然無法直接測得,但可通過間接的方法測定.現根據下列3個熱化學反應方程式:
(1)蓋斯定律在生產和科學研究中有很重要的意義.有些反應的反應熱雖然無法直接測得,但可通過間接的方法測定.現根據下列3個熱化學反應方程式:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2012-2013學年山東省威海市高二上學期期末考試化學試卷(帶解析) 題型:填空題
(1)蓋斯定律在生產和科學研究中有很重要的意義。有些反應的反應熱雖然無法直接測得,但可通過間接的方法測定。現根據下列3個熱化學反應方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.4kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
寫出CO氣體還原FeO固體得到Fe 固體和CO2氣體的熱化學反應方程式:
。
(2)在壓強為0.1 MPa條件下,容積為V L某密閉容器中a mol CO與 2a mol H2在催化劑作用下反應生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的轉化率與溫度、壓強的關系如圖所示。
CH3OH(g);CO的轉化率與溫度、壓強的關系如圖所示。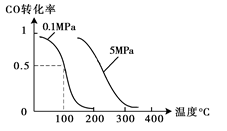
①該反應的△H 0 (填“<”、“>”或“=”)。
②在溫度容積不變的情況下,向該密閉容器再
增加a mol CO與 2a mol H2,達到新平衡時,CO的轉化率 (填“增大”、“減小”或“不變”)。
(3)實驗室中配制AgNO3溶液時通常需要向其中加入 ,目的是 ; AgCl在水中存在沉淀溶解平衡:
AgCl(s) Ag+(aq)+Cl-(aq)。25oC時,現將足量AgCl分別放入:①l00mL蒸餾水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化鎂溶液;④100mL 0.1 mol?L-1氯化鈉溶液。充分攪拌后,相同溫度下Ag+濃度由大到小的順序是 (填寫序號)。
Ag+(aq)+Cl-(aq)。25oC時,現將足量AgCl分別放入:①l00mL蒸餾水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化鎂溶液;④100mL 0.1 mol?L-1氯化鈉溶液。充分攪拌后,相同溫度下Ag+濃度由大到小的順序是 (填寫序號)。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年山東省威海市高二(上)期末化學試卷(解析版) 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com