
【題目】下圖是表示4個碳原子相互結合的方式。小球表示碳原子,小棍表示化學鍵,假如碳原子上其余的化學鍵都是與氫原子結合。

(1)圖中屬于烷烴的是________(填字母)
(2)在上圖的有機化合物中,碳原子與碳原子之間不僅可以形成共價單鍵,還可以形成______和______;不僅可以形成________,還可以形成碳環。
(3)上圖中互為同分異構體的是:A與________;B與________;D與________(填字母)
(4)寫出圖中C物質結構簡式:____________________。
【答案】 A、C 碳碳雙鍵 碳碳三鍵 碳鏈 C E、F、H G CH(CH3)3
【解析】根據物質的球棍模型可知A是丁烷,B是2-丁烯,C是異丁烷,D是2-丁炔,E是1-丁烯,F是2-甲基-1-丙烯,G是1-丁炔,H是環丁烷,據此解答。
(1)烴分子中碳原子之間以單鍵相結合,剩余價鍵全部與氫原子結合,使每個碳原子的化合價都達到飽和,烷烴又叫飽和鏈烴,因此圖中屬于烷烴的是丁烷、異丁烷,答案選AC。
(2)根據模型可知在上圖的有機化合物中,碳原子與碳原子之間不僅可以形成共價單鍵,還可以形成碳碳雙鍵和碳碳三鍵;不僅可以形成碳鏈,還可以形成碳環。
(3)分子式相同結構不同的化合物互為同分異構體,上圖中互為同分異構體的是:丁烷與異丁烷;2-丁烯與1-丁烯、2-甲基-1-丙烯、環丁烷;2-丁炔與環丁烷。
(4)圖中C物質是異丁烷,結構簡式為CH(CH3)3。


 智慧課堂密卷100分單元過關檢測系列答案
智慧課堂密卷100分單元過關檢測系列答案科目:高中化學 來源: 題型:
【題目】高鐵酸鉀是一種高效的多功能水處理劑,具有強氧化性。制備高鐵酸鉀方法很多。
(1)干法制備高鐵酸鉀。將Fe2O3、KNO3、KOH混合加熱共熔生成紫紅色高鐵酸鹽和KNO2等產物。此制備反應中,氧化劑與還原劑的物質的量之比為_____________________。
(2)濕法制備高鐵酸鉀。工業上常采用NaClO氧化法生產,原理如下:
a.3NaClO+2Fe(NO3)3+ 10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
b.Na2FeO4+2KOH =K2FeO4+2NaOH
主要的生產流程如圖:

①流程圖中“轉化”是在某低溫下進行的,說明此溫度下的溶解度S(K2FeO4)_____S(Na2FeO4)(填“>”“<”或“=”)。
②濕法制備中,反應的溫度、原料的濃度和配比對高鐵酸鉀的產率都有影響。如圖,圖甲為不同的溫度下,不同質量濃度的Fe(NO3)3對K2FeO4生成率的影響;圖乙為一定溫度下,Fe(NO3)3質量濃度最佳時,NaClO濃度對K2FeO4生成率的影響。工業生產中最佳溫度為_________℃,此時Fe(NO3)3與NaClO 兩種溶液最佳質量濃度之比為______________。

③若NaClO加入過量,氧化過程中會生成Fe(OH)3,寫出該反應的離子方程式:_____________________。若Fe( NO3)3加入過量,在堿性介質中K2FeO4與Fe3+發生氧化還原反應生成K3FeO4,此反應的離子方程式為__________________________________。
(3)K2FeO4在水溶液中易水解:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。
①在“提純”K2FeO4中采用重結晶、洗滌、低溫烘干的方法,則洗滌劑最好選用__________溶液(填序號)。
A.H2O B.CH3COOK、異丙醇 C.NH4Cl、異丙醇 D.Fe(NO3)3、異丙醇
②K2FeO4在處理水的過程中所起的作用有_______________________。
(4)室溫下,向含有Fe3+的CuSO4溶液中加入Cu(OH)2可使Fe3+轉化為Fe(O H)3沉淀,從而除去Fe3+。該反應的平衡常數為_____________________。(已知常溫下的溶度積常數:Ksp[Cu(OH)2]=2.0×10-20, Ksp[Fe(OH)3]=4.0×10-38)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溫度不變恒容的容器中進行反應H2![]() 2H,若反應物濃度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.036mol·L-1所需反應時間應為
2H,若反應物濃度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.036mol·L-1所需反應時間應為
A. 等于10s B. 等于12s C. 大于12s D. 小于12s
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有下列各組微粒或物質:
A、O2和O3
B、 ![]() 和
和 ![]()
C、CH3CH2CH2CH3和 ![]()
D、 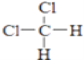 和
和 
E、CH3CH2CH2CH3和 ![]()
(1)________組兩種微粒互為同位素;
(2)________組兩種物質互為同素異形體;
(3)________組兩種物質屬于烴;
(4)________組兩物質互為同分異構體;
(5)________組兩物質是同一物質.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏伽德羅常數的數值,下列說法錯誤的是( )
A.常溫常壓下,1 mol氦氣含有的核外電子數為2NA
B.1.7gCH5+離子中含有的電子總數為NA
C.1molC10H22分子中共價鍵總數為31 NA
D.1molNO2與足量水反應時共轉移2NA個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W 是短周期中原子序數依次增大的四種元素。X可以分別與Y、Z、W 結合生成甲、乙、丙三種相同質子數的分子;相關物質之間的轉化關系如圖所示,已知丁是無色氣體,遇空氣顯紅棕色。下列說法正確的是
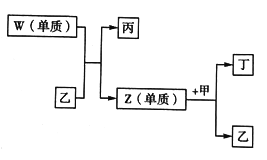
A. 原子半徑的大小:W>X>Y>Z B. 單質的穩定性:X>Y>Z>W
C. 簡單氫化物的沸點:Y>Z>W D. X 與Y、Z 均可形成原子個數比為2: 1的化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用固體硫酸亞鐵制取顏料鐵紅(Fe2O3),反應原理是:
2FeSO4 Fe2O3 + SO2↑+SO3↑,某學生欲檢驗該反應所產生的氣態物質,他依次將氣體通過盛有(I)BaCl2溶液、(II)x溶液、(III)NaOH溶液的三個裝置。則下列對該方案的評價中正確的是( )
A.(I)中會生成BaSO3、BaSO4兩種沉淀
B.可將(I)中的BaCl2溶液改為Ba(NO3)2溶液
C.(III)的作用是檢驗生成的SO2氣體
D.(II)所盛x應為品紅溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用蒸餾水逐步稀釋0.2 mol/L的稀氨水時,若溫度不變,在稀釋過程下列數據始終保持增大趨勢的是( )
A.c(OH-) B.c(NH4+) C.c(NH3·H2O) D.c(NH4+)/c(NH3·H2O)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com