
分析 (1)反應后的溶液中存在碳酸根離子,則碳酸鈉與鹽酸反應沒有生成二氧化碳氣體,CO32-和HCO3-的物質的量之和等于原溶液中碳酸鈉的物質的量;設出原溶液中碳酸鈉、碳酸氫鈉的物質的量分別為x、y,根據反應后的溶液中CO32-和HCO3-的物質的量之比為2:1可知反應生成碳酸氫鈉的物質的量為$\frac{1}{3}$y,然后分別根據鈉離子守恒、消耗氯化氫的總物質的量列式計算,最后根據c=$\frac{n}{V}$計算出原溶液中氫氧化鈉、碳酸鈉的濃度;
(2)當完全反應得到NaCl溶液時甲基橙變色,根據鈉離子和氯離子物質的量相等列式計算;
(3)根據碳原子守恒,若反應完全時n(CO2)=n(Na2CO3)-n(H2CO3),帶入V=n•Vm計算體積.
解答 解:(1)設原混合液中NaOH和Na2CO3的物質的量分別為x和y則:
NaOH+HCl═NaCl+H2O
x x
Na2CO3+HCl═NaHCO3+NaCl
$\frac{y}{3}$ $\frac{y}{3}$
$\left\{\begin{array}{l}{x+2y=4.4mol•{L}^{-1}×0.1L}\\{x+\frac{y}{3}=2.0mol•{L}^{-1}×0.12L}\end{array}\right.$
解得x=0.2mol,y=0.12mol,
c(NaOH)=$\frac{0.2mol}{0.1L}$=2mol/L,
c(Na2CO3)=$\frac{0.12mol}{0.1L}$=1.2mol/L,
答:原混合液中NaOH和Na2CO3的物質的量濃度分別為2mol/L、1.2mol/L;
(2)4.4 mol•L-1×0.1L=2 mol•L-1V(鹽酸)+0.120L×2 mol•L-1,
解得V(鹽酸)=100mL,
答:若用甲基橙作指示劑,在滴定時尚需再加100ml升鹽酸,才能使甲基橙變色;
(3)根據碳原子守恒,若反應完全時n(CO2)=n(Na2CO3)-n(H2CO3)=0.12mol-0.04 mol•L-1×0.32L=0.107mol,
V(CO2)=0.107mol×22.4L/mol=2.4L,
答:若反應完全時,溶液中H2CO3的濃度為0.04mol•L-1且溶液體積假定不變,可得CO2氣體2.4升.
點評 本題考查了混合物反應的有關計算,題目難度中等,明確反應的先后順序及反應產物為解答關鍵,注意質量守恒在化學計算中的應用方法,試題有利于培養學生的分析、理解能力及化學計算能力.


科目:高中化學 來源: 題型:解答題
| 物質 | 組成和結構信息 |
| a | 含有非極性共價鍵的二元離子化合物,且原子數之比為1:1 |
| b | 化學組成為BDF2 |
 ,其中B原子的雜化方式為sp2.
,其中B原子的雜化方式為sp2.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
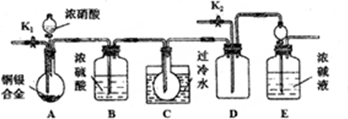
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
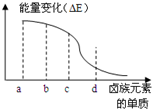 鹵族元素的單質(F2、Cl2、Br2、I2)與H2反應過程中的能量變化如右圖所示,其中a、b、c、d分別表示鹵族中某一元素的單質,△E為相同物質的量的單質與H2反應過程中的能量變化(△E越大,表明反應越容易發生).請回答下列問題:
鹵族元素的單質(F2、Cl2、Br2、I2)與H2反應過程中的能量變化如右圖所示,其中a、b、c、d分別表示鹵族中某一元素的單質,△E為相同物質的量的單質與H2反應過程中的能量變化(△E越大,表明反應越容易發生).請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑A<B<C | |
| B. | A、B、C的固態氧化物分別是分子晶體、離子晶體和原子晶體 | |
| C. | A單質的熔點高于C單質 | |
| D. | A與B或C均可形成離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應NH3(g)+HCl(g)═NH4Cl(s)在室溫下可自發進行,則該反應的△H>0 | |
| B. | 硅單質可用作光導纖維的原料 | |
| C. | CH3COOH 溶液加水稀釋后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值減小 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2 固體,CO32-水解程度減小,溶液pH 減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 因為乙醇是有機物,所以乙醇不溶于水 | |
| B. | 乙醇能燃燒 | |
| C. | 乙醇在一定條件下能夠被氧化成乙醛 | |
| D. | 乙醇能與水以任意比例混溶 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com