
【題目】高爐煉鐵是冶煉鐵的主要方法,發生的主要反應為:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1
則a = kJ mol-1。
(2)冶煉鐵反應的平衡常數表達式K = ,溫度升高后,K值 (填“增大”、“不變”或“減小”)。
(3)在T℃時,該反應的平衡常數K=64,在2 L恒容密閉容器甲和乙中,分別按下表所示加入物質,反應經過一段時間后達到平衡。
Fe2O3 | CO | Fe | CO2[ | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡轉化率為 。
② 下列說法正確的是 (填字母)。
a.若容器內氣體密度恒定時,標志反應達到平衡狀態
b.甲容器中CO的平衡轉化率大于乙的
c.甲、乙容器中,CO的平衡濃度之比為2∶3
d.增加Fe2O3可以提高CO的轉化率
(4)采取一定措施可防止鋼鐵腐蝕。下列裝置中的燒杯里均盛有等濃度、等體積的NaCl溶液。
①在a~c裝置中,能保護鐵的是 (填字母)。
②若用d裝置保護鐵,X極的電極材料應是 (填名稱)。

【答案】(1)-28.5 (2) C3(CO2)/ C3(CO) 減小
(3)① 60 % ② ac(漏選得1分,錯選不得分)
(4)① bc(漏選得1分,錯選不得分);② 鋅
【解析】
試題分析:(1))①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由蓋斯定律①-②×3得到Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=-28.5kJmol-1,故答案為:-28.5;-28.5 。(2)Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=-28.5kJmol-1,平衡常數K= C3(CO2)/ C3(CO) 反應是放熱反應,升溫平衡逆向進行,平衡常數減小 。
(3)①在T℃時,該反應的平衡常數K=64,在2L恒容密閉容器甲中,加入物質反應達到平衡,設消耗一氧化碳物質的量為x
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
變化量(mol) x x
平衡量(mol) 1-x 1+x
![]() ,計算得到x=0.6,轉化率=60 % 。②a.反應前后氣體質量變化,體積不變,若容器內氣體密度恒定時,標志反應達到平衡狀態,故a正確;b、反應前后氣體體積相同,所以增加反應物的物質的量,等同于加壓,平衡不移動,平衡轉化率相同,故錯誤;c、甲容器中平衡一氧化碳物質的量為0.4mol;乙容器中結合平衡常數計算得到消耗一氧化碳為1.4mol,平衡物質的量為0.6mol,甲和乙容器中CO的平衡濃度之比為0.4+0.6=2:3,故正確;d、固體量增加不影響化學平衡,增加Fe2O3不能提高CO的轉化率,故錯誤。故選 ac。(4)①a、鐵做陽極,失去電子,故沒有被保護;b、鐵做陰極,被保護;c、鐵做正極,被保護;故選bc。②保護鐵,則讓鐵做原電池的正極,X活動性比鐵強,可以為鋅。
,計算得到x=0.6,轉化率=60 % 。②a.反應前后氣體質量變化,體積不變,若容器內氣體密度恒定時,標志反應達到平衡狀態,故a正確;b、反應前后氣體體積相同,所以增加反應物的物質的量,等同于加壓,平衡不移動,平衡轉化率相同,故錯誤;c、甲容器中平衡一氧化碳物質的量為0.4mol;乙容器中結合平衡常數計算得到消耗一氧化碳為1.4mol,平衡物質的量為0.6mol,甲和乙容器中CO的平衡濃度之比為0.4+0.6=2:3,故正確;d、固體量增加不影響化學平衡,增加Fe2O3不能提高CO的轉化率,故錯誤。故選 ac。(4)①a、鐵做陽極,失去電子,故沒有被保護;b、鐵做陰極,被保護;c、鐵做正極,被保護;故選bc。②保護鐵,則讓鐵做原電池的正極,X活動性比鐵強,可以為鋅。


 口算題卡北京婦女兒童出版社系列答案
口算題卡北京婦女兒童出版社系列答案科目:高中化學 來源: 題型:
【題目】400mL某溶液中含有0.1mol Fe2+、0.2mol Fe3+加入0.2mol鐵粉,待Fe3+反應完全后,溶液中Fe2+的物質的量濃度為(假設反應前后溶液體積不變)( )
A.0.4mol·L-1 B.0.6mol·L-1 C.0.8mol·L-1 D.1.0mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組用下圖裝置制備家用消毒液,并探究其性質。
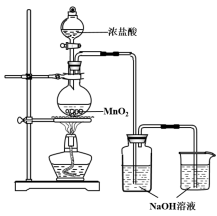
反應停止后,取洗氣瓶中無色溶液5mL分別進行了如下實驗:
操作 | 現象 |
a. 測溶液pH, 并向其中滴加2滴酚酞 | pH = 13, 溶液變紅,5min后褪色 |
b. 向其中逐滴加入鹽酸 | 溶液逐漸變成黃綠色 |
(1)寫出利用上述裝置制備消毒液涉及反應的化學方程式 、 。
(2)查閱資料:酚酞的變色范圍為8.2~10,且酚酞在強堿性溶液中紅色會褪去
為探究操作a中溶液褪色的原因,又補充了如下實驗:
操作 | 現象 |
取 NaOH溶液,向其中滴加2滴酚酞 | 溶液變紅,30min后褪色 |
獲得結論:此實驗小組制備的消毒液具有 性。
(3) 該小組由操作b獲得結論:隨著溶液酸性的增強,此消毒液的穩定性下降。
① 操作b中溶液變成黃綠色的原因: (用離子方程式表示)。
② 有同學認為由操作b獲得上述結論并不嚴謹,需要進一步確認此結論的實驗方案是 。
(4) 有效氯的含量是檢測含氯消毒劑消毒效果的重要指標。具體用“單位質量的含氯消毒液在酸性條件下所能釋放出氯氣的質量”進行表征,一般家用消毒液有效氯含量在5%以上。小組同學進行如下實驗測定有效氯:取此消毒液5 g,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液;加幾滴淀粉溶液后,用0.1 mol·L-1 Na2S2O3溶液滴定生成的I2,達滴定終點時消耗Na2S2O3 20 mL。(已知:2S2O32- + I2 === S4O62- + 2I-) 。注:相對原子質量Cl35.5,Na23,S32,O 16 ,I 127, K39
①達到滴定終點時的實驗現象是 。
②此消毒液有效氯含量為 %(保留一位有效數字)。獲得結論:此實驗制得的消毒液 (填“符合”或“不符合”)家用要求。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機物的說法中,錯誤的是
A. 乙烯在常溫常壓下是氣體,能使溴的四氯化碳溶液褪色
B. 苯可做有機溶劑,能使酸性高錳酸鉀溶液褪色
C. 乙醇和乙烷都能發生取代反應
D. 乙酸乙酯在酸性條件下可以水解生成乙酸和乙醇
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧燃料電池可以使用在航天飛機上,其反應原理示意圖如下圖。下列有關氫氧燃料電池的說法正確的是
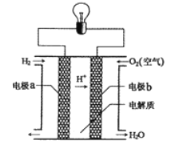
A.該電池工作時電能轉化為化學能
B.該電池中電極a是正極
C.外電路中電子由電極b通過導線流向電極a
D.該電池的總反應:2H2+O2=2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數的數值。下列說法不正確的是
A.0.05 mol液態KHSO4中含有0.05 NA個陽離子
B.氫氧燃料電池正極消耗22.4 L氣體時,電路中通過電子的數目為4 NA
C.常溫下,100 mL 1 molL-l鹽酸與4.6 g鈉反應生成H2分子數目為0.1NA
D.在電解精煉粗銅的過程中,當陰極析出32 g銅時轉移電子數目為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.乙烯是石油裂解氣的主要成分,下圖是石蠟油在熾熱碎瓷片的作用下裂解,下列裝置檢驗其性質,完成下列問題。

(1)A中碎瓷片的作用是_____________。
(2)B中反應類型是_____________,C中實驗現象是__________________。
II.用如圖所示的裝置進行實驗,回答下列問題:
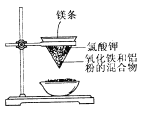
(1)寫出該反應的化學方程式:_____________________。
(2)選出該實驗的實驗現象(把序號填寫在橫線上):________________。
①鎂條劇烈燃燒;②放出大量的熱,并發出耀眼的光芒;③紙漏斗的下部被燒穿;④有紅熱狀態的液珠落入蒸發皿內的細沙上,液珠冷卻后變為黑色固體。
(3)寫出下列操作或物質的作用:鎂條________;氯酸鉀_________;蒸發皿盛沙____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二甲酸鉀是一種白色晶體,商品名為弗米(Formil),是一種能替代抗生素的促生長劑,化學式為KH(HCOO)2,具有吸濕性,易溶于水。
二甲酸鉀的生產工藝流程如下:
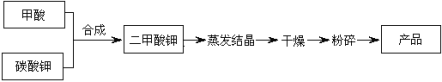
(1)寫出甲酸和碳酸鉀生產二甲酸鉀的化學方程式: 。
(2)測定某弗米產品純度的實驗方法如下:
稱取該弗米產品2.5g,將其全部溶解在水中,配制成250mL未知濃度的溶液,取出25.00mL于錐形瓶中,再滴加2~3滴指示劑,用0.10mol·L-1的NaOH溶液滴定至終點,消耗NaOH溶液的體積為18.50mL。
①加入的指示劑是 (選填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至終點的現象是 。
②上述弗米產品中二甲酸鉀的質量分數為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“C化學”是指以碳單質或分子中含1個碳原子的物質(如CO、CO2、CH4、CH3OH等)為原料合成工業產品的化學工藝,對開發新能源和控制環境污染有重要意義。
(1)一定溫度下,在兩個容積均為2 L的密閉容器中,分別發生反應:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH=-49.0 kJ/mol。相關數據如下:
CH3OH(g) + H2O(g) ΔH=-49.0 kJ/mol。相關數據如下:
容器 | 甲 | 乙 |
反應物投入量 | 1 mol CO2(g)和3 mol H2(g) | 1 mol CH3OH(g)和1 mol H2O(g) |
平衡時c(CH3OH) | c1 | c2 |
平衡時能量變化 | 放出29.4 kJ | 吸收a kJ |
請回答:①c1 c2(填“>”、“<”或“=”);a= 。
②若甲中反應達到平衡耗時10 s,則用CO2來表示甲中反應從開始到平衡過程中的平均反應速率是_____mol/(L·s)。
(2)向體積為1 L的密閉容器中充入b mol CO和2b mol H2,發生反應CO(g)+2H2(g)![]() CH3OH(g)。平衡時CO的轉化率與溫度的關系如圖所示。請回答下列問題:
CH3OH(g)。平衡時CO的轉化率與溫度的關系如圖所示。請回答下列問題:

①正反應屬于 (填“吸”或“放”)熱反應。
②100℃時,該反應的平衡常數K= (用含b的代數式表示)。
(3)治理汽車尾氣的反應是2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。在恒溫恒容的密閉容器中通入n(NO):n(CO)=1:2的混合氣體,發生上述反應。下列圖像正確且能說明反應在進行到t1時刻一定達到平衡狀態的是 (選填字母)
2CO2(g)+N2(g) ΔH<0。在恒溫恒容的密閉容器中通入n(NO):n(CO)=1:2的混合氣體,發生上述反應。下列圖像正確且能說明反應在進行到t1時刻一定達到平衡狀態的是 (選填字母)
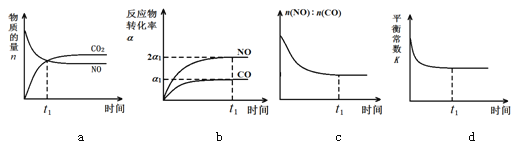
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com