
分析 (1)依據鉛蓄電池的總反應方程式中元素化合價變化判斷,負極失電子發生氧化反應;正極得到電子發生還原反應,負極 Pb+SO42-=PbSO4+2e-;正極 PbO2+4H++SO42-+2e-=PbSO4+2H2O;
(2)依據放電時的正極和負極反應書寫放電時的總反應方程式;
(3)①根據鉛蓄電池總反應式為 Pb+PbO2+2H2SO4 $?_{充電}^{放電}$2H2O+2PbSO4得出,消耗2moL硫酸轉移2mol電子計算;
②根據精煉銅陰極反應為Cu2++2e-=Cu計算.
解答 解:(1)鉛蓄電池總的化學方程式為:Pb+PbO2+2H2SO4 $?_{充電}^{放電}$2H2O+2PbSO4;鉛失電子生成硫酸鉛,負極電極反應為:Pb+SO42--2e-=PbSO4,故答案為:Pb+SO42--2e-=PbSO4;
(2)鎳鎘堿性充電電池在放電時,正極反應為:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-,負極反應為:Cd+2OH--2e-=Cd(OH)2,合并得到放電時的總反應方程式為:Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2;
故答案為:Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2;
(3)①由鉛蓄電池總反應式為 Pb+PbO2+2H2SO4 $?_{充電}^{放電}$2H2O+2PbSO4得出,消耗2moL硫酸轉移2mol電子,則電解過程中轉移了0.2mol電子,鉛蓄電池內消耗硫酸的物質的量是0.2mol,故答案為:0.2;
②因為精煉銅陰極反應為Cu2++2e-=Cu,所以電解過程中轉移了0.2mol電子,則生產精銅6.4g,故答案為:6.4.
點評 本題考查了原電池的原理應用和電解原理應用,電極反應及其相關計算,電池反應是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3溶液和稀鹽酸 | B. | NaHCO3溶液和稀鹽酸 | ||
| C. | AlCl3溶液和NH3•H20溶液 | D. | 澄清石灰水和NaHCO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 物質 | N2 | Cl2 | Br2 | I2 | O2 |
| 鍵能 (kJ•mol-1) | 945 | 243 | 193 | 151 | 498 |
| 鍵長(nm) | 0.110 | 0.199 | 0.228 | 0.266 | 0.121 |
| A. | N2>Cl2>Br2>O2>I2 | B. | O2>N2>I2>Br2>Cl2 | ||
| C. | I2>Br2>Cl2>O2>N2 | D. | N2>O2>Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉加入水中:Na+H2O=Na++OH-+H2↑ | |
| B. | 碳酸氫鈣溶液跟氫氧化鈉溶液混合:HCO3-+OH-=CO32-+H2O | |
| C. | 氫氧化鋇溶液滴入硫酸氫鈉溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| D. | 亞硫酸鈉和足量的稀硝酸混合:SO32-+2H+=SO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過濾時,液面超過濾紙的邊緣 | |
| B. | 加熱試管內物質時,試管底部與酒精燈燈芯接觸 | |
| C. | 過濾時,漏斗下端緊貼燒杯內壁 | |
| D. | 向試管中滴加液體時,膠頭滴管緊貼試管內壁 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能使潤濕的淀粉KI試紙變成藍色的物質一定是Cl2 | |
| B. | 實驗室制氯氣時,用飽和NaHCO3溶液和濃硫酸凈化氣體 | |
| C. | 單質硅是生產光纖制品的基本原料 | |
| D. | 水玻璃可用于生產黏合劑和防火劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
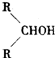 最難
最難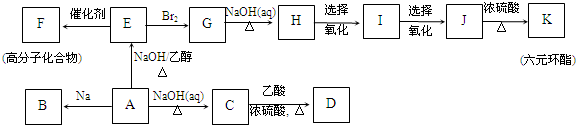
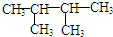 ,K為
,K為 ;
;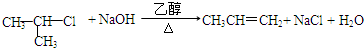 ;G→H
;G→H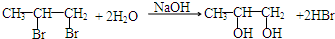 ;
;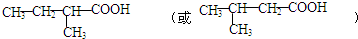 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | V1≤V2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com